Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Inorgânica
TÍTULO: Estudo ab initio da estabilidade e do potencial eletrostático de um complexo formado no sistema alumínio-fosfocreatina-água
AUTORES: Tenório, T. (PUC-RIO) ; Ramos, J.M. (UFRJ) ; Buarque, C.D. (PUC-RIO)
RESUMO: A fosfocreatina serve como estoque temporário de energia. Na doença de Alzheimer, a captura de glicose pelas células sofre obliteração, interferindo no ciclo de Krebs. O sistema creatina-fosfocreatina também é afetado no cérebro de pacientes com Alzheimer. O íon alumínio é associado com essa doença e ocasiona a diminuição da viabilidade celular. Um dos complexos formados pelo Al(III) e a fosfocreatina em solução aquosa foi estudado pela teoria do funcional de densidade (DFT:B3LYP/6-311++G**) considerando o efeito do solvente água (modelo de contínuo polarizável). As cargas de Mulliken, os orbitais moleculares de fronteira e o potencial eletrostático foram examinados.
PALAVRAS CHAVES: Potencial eletrostático; HOMO; LUMO
INTRODUÇÃO: A fosfocreatina é uma molécula de creatina fosforilada sintetizada no fígado e transportada para células onde serve como estoque temporário de energia. Na doença de Alzheimer, a captura de glicose pelas células sofre obliteração, o que causa decréscimo dos níveis de adenosina 5'-trisfosfato e interfere no ciclo de Krebs. A produção de aspartato, glutamato e fosfocreatina também são comprometidas (BUTTERFIELD, 2002).
O sistema creatina-fosfocreatina também é afetado in vitro e in vivo nas condições neuropatogênicas do Alzheimer (MIHARA et al., 2006). Além disso, a creatina, produto de hidrólise da fosfocreatina, pode modular o processo de transmissão de informação e atuar como neuromodulador (ALMEIDA et al., 2006).
O alumínio(III), encontrado comumente em pequenas concentrações no corpo humano, é ligado ao Alzheimer, doença neurodegenerativa com alta incidência entre idosos (FERREIRA et al., 2008). Este metal aumenta a fosforilação da proteína Tau, a degeneração neuronal e a neurotoxicidade de placas amiloides e sua agregação, condições relativas à neuropatogenêse do Alzheimer (DRAGO et al., 2008).
O presente estudo possui como objetivo investigar a estabilidade e a distribuição eletrônica em solução aquosa do complexo [Al(PCr)(H2O)].
MATERIAL E MÉTODOS: Os cálculos computacionais foram realizados no programa Gaussian 03W (FRISCH et al., 2003). Empregou-se a teoria do funcional de densidade (DFT), com funções híbridas B3LYP e a base 6-311++G**. Todos os cálculos consideraram o solvente água pelo modelo de contínuo polarizável (PCM). As cargas de Mulliken, os orbitais moleculares (HOMO -1, HOMO, LUMO e LUMO +1), o mapa do potencial eletrostático e a superfície de contorno do potencial eletrostático foram investigados.
A estrutura do complexo foi proposta em estudo prévio (TENÓRIO E FELCMAN, 2010), que usou como técnicas a potenciometria, a espectroscopia Raman, a RMN de 31P e de 27Al e a modelagem molecular. O arranjo tetraédrico distorcido é adotado pelo complexo e a fosfocreatina comporta-se como ligante tridentado. Os átomos doadores participantes da esfera de coordenação do Al(III) são um oxigênio do carboxilato, um oxigênio do fosfato e um nitrogênio do grupo guanidino. A quarta posição é ocupada por uma molécula de água coordenada. O complexo pode ser observado na figura 1.
RESULTADOS E DISCUSSÃO: A distribuição de cargas de Mulliken adota o sistema de cores: tons de vermelho mostram cargas negativas enquanto tons de verde mostram positivas. A distribuição de carga, figura 1, mostra que o Al(III) possui a maior carga de Mulliken. Todos os hidrogênios possuem carga de Mulliken positiva e todos os oxigênios têm carga de Mulliken negativa.
O [Al(PCr)(H22)] possui 65 orbitais ocupados. Na figura 1 são observados os orbitais HOMO-1, HOMO, LUMO e LUMO+1. Nota-se que nos orbitais HOMO-1 e HOMO, os elétrons estão localizados principalmente na parte molecular do ligante, enquanto nos LUMO e LUMO+1, os elétrons estão por todo o complexo, especialmente sobre o alumínio(III), a água coordenada e o grupo guanidino.
O valor do “gap” HOMO-LUMO na molécula é de 5,61 eV, o que sugere alta estabilidade cinética e baixa reatividade química.
As linhas de contorno do potencial eletrostático mostram uma seção planar em particular de superfícies equipotenciais. Linhas de contorno amarelo mostram potencial positivo e linhas vermelhas, negativo.
Ao redor do alumínio(III) o potencial é positivo, ocasionado por uma deficiência de elétrons, figuras 2a e 2b. Os átomos de oxigênio não ligados ao Al(III) apresentam um campo eletrostático mais forte, logo há uma variação mais intensa de potencial nessas regiões, figuras 2c e 2d.
No mapa do potencial eletrostático, o potencial cresce na seguinte ordem: vermelho<laranja<amarelo<verde<ciano<azul.
O mapa do potencial eletrostático da molécula, figura 1, apresenta diversas regiões de potencial próximo à zero (verde). O complexo tem regiões com potencial mais positivo sobre a água coordenada (verde azulado) e mais negativo sobre os átomos de oxigênios não ligados ao alumínio(III) (verde amarelado).
Figura 1. [Al(PCr)(H2O)]
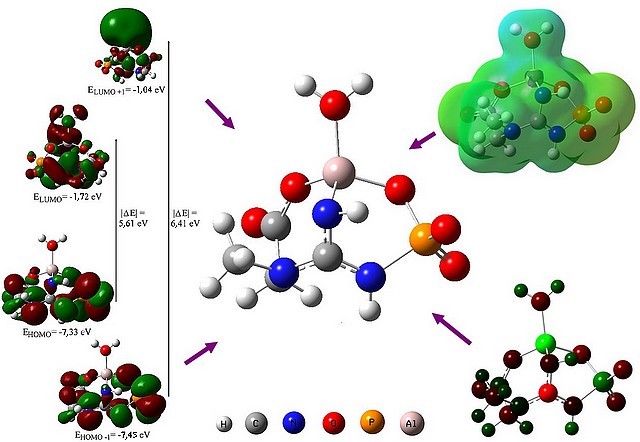
[Al(PCr)(H2O)]: estrutura molecular, distribuição de cargas de Mulliken, mapa do potencial eletrostático e superfícies dos orbitais moleculares.
Figura 2.
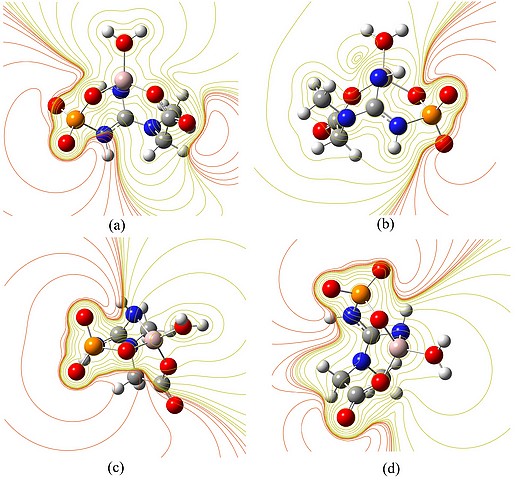
Superfícies de contorno do potencial eletrostático do complexo [Al(PCr)(H2O)] em diferentes planos.
CONCLUSÕES: A distribuição de cargas de Mulliken e o potencial eletrostático são ferramentas complementares. Nesta pesquisa, tais propriedades são concordantes. As linhas de contorno do potencial eletrostático mostram que a molécula apresenta superfícies tanto de potencial positivo quanto de negativo. O mapa do potencial mostra a presença de regiões “neutras” (verde) ao redor dos átomos e como a carga total da molécula é igual à zero, a molécula deve ser solúvel em lipídios.
O “gap” HOMO-LUMO indica que o complexo possui alta estabilidade cinética e baixa reatividade química, logo a estrutura é estável.
AGRADECIMENTOS: O trabalho foi apoiado pelo CNPq, pela PUC-Rio e pela UFRJ.
REFERÊNCIAS BIBLIOGRÁFICA: ALMEIDA, L. S.; SALOMONS, G. S.; HOGENBOOM, R.; JAKOBS, C.; SCHOFFELMEER, A. N. M. 2006. Exocytotic release of creatine in rat brain. Synapse, 60: 118-123.
BUTTERFIELD, D. A. 2002. Amyloid beta-peptide (1-42)-induced oxidative stress and neurotoxicity: Implications for neurodegeneration in Alzheimer's disease brain. Free Radical Research, 36: 1307-1313.
DRAGO, D.; CAVALIERE, A.; MASCETRA, N.; CIAVARDELLI, D.; DI ILIO, C.; ZATTA, P.; SENSI, S. L. 2008. Aluminum Modulates Effects of beta Amyloid(1-42) on Neuronal Calcium Homeostasis and Mitochondria Functioning and Is Altered in a Triple Transgenic Mouse Model of Alzheimer's Disease. Rejuvenation Research, 11: 861-871.
FERREIRA, P. C.; PIAI, K. A.; TAKAYANAGUI, A. M.; SEGURA-MUÑOZ, S. I. 2008. Aluminum as a risk factor for Alzheimer's disease. Revista Latino-Americana de Enfermagem, 16: 151-157.
FRISCH, M.J.; TRUCKS, G.W.; SCHLEGEL, H.B.; SCUSERIA, G.E.; ROBB, M.A.; CHEESEMAN, J.R.; MONTGOMERY, J.A.; VREVEN, JR., T.; KUDIN, K.N.; BURANT, J.C.; MILLAM, J.M.; IYENGAR, S.S.; TOMASI, J.; BARONE, V.; MENNUCCI, B.; COSSI, M.; SCALMANI, G.; REGA, N.; PETERSSON, G.A.; NAKATSUJI, H.; HADA, M.; EHARA, M.; TOYOTA, K.; FUKUDA, R.; HASEGAWA, J.; ISHIDA, M.; NAKAJIMA, T.; HONDA, Y.; KITAO, O.; NAKAI, H.; KLENE, M.; LI, X.; KNOX, J.E.; HRATCHIAN, H.P.; CROSS, J.B.; ADAMO, C. ; JARAMILLO, J.; GOMPERTS, R.; STRATMANN, R. E.; YAZYEV, O.; AUSTIN, A. J.; CAMMI, R.; POMELLI, C.; OCHTERSKI, J. W.; AYALA, P.Y.; MOROKUMA, K.; VOTH, G. A.; SALVADOR, P.; DANNENBERG, J.J.; ZAKRZEWSKI, V.G.; DAPPRICH, S.; DANIELS, A.D.; STRAIN, M.C. ; FARKAS, O.; MALICK, D. K.; RABUCK, A. D.; RAGHAVACHARI, K.; FORESMAN, J. B.; ORTIZ, J. V.; CUI, Q.; BABOUL, A. G.; CLIFFORD, S.; CIOSLOWSKI, J.; STEFANOV, B. B.; LIU, G.; LIASHENKO, A.; PISKORZ, P.; KOMAROMI, I.; MARTIN, R.L.; FOX, D.J.; KEITH, T.; AL-LAHAM, M.A.; PENG, C. Y.; NANAYAKKARA, A.; CHALLACOMBE, M.; GILL, P. M. W.; JOHNSON, B.; CHEN, W.; WONG, M. W.; GONZALEZ, C.; POPLE, J. A. 2003. Gaussian, Inc., Pittsburgh.
MIHARA, M.; HATTORI, N.; ABE, K.; SAKODA, S.; SAWADA, T. 2006. Magnetic resonance spectroscopic study of Alzheimer's disease and frontotemporal dementia/Pick complex. Neuroreport, 17: 413-416.
TENÓRIO, T.; FELCMAN, J. 2010. Estudo de complexos binários de alumínio(III) com aminoácidos sulfurados e ligantes fosfatados. Dissertação (Química), PUC-RJ.
