Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Inorgânica
TÍTULO: Síntese e caracterização de um complexo de ferro(III) com um ligante tripodal N3O doador
AUTORES: Gomes, C.A. (INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGI) ; Horn Junior, A. (UNIVERSIDADE ESTADUAL DO NORTE FLUMINENSE DARCY RI) ; Fernandes, C. (UNIVERSIDADE ESTADUAL DO NORTE FLUMINENSE DARCY RI) ; Lube, L.M. (INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGI)
RESUMO: Complexos de ferro têm sido avaliados como catalisadores em reações de oxidação de hidrocarbonetos, compostos antifúngicos, antitumorais e antimicrobianos. Assim, visando a vasta possibilidade de aplicação desses compostos, este trabalho apresenta a síntese e caracterização de um complexo de ferro(III), a partir da reação entre FeCl3.6H2O e o ligante N3O doador 3-[2-hidroxibenzil(2-piridilmetil)amino]propanoamida (L1). O ligante em questão foi sintetizado e caracterizado por análises de espectroscopia no infravermelho (IV) e RMN de 1H e 13C. O complexo [FeIII(L1)Cl2] foi obtido em forma de pó e foi caracterizado através de análises de condutivimetria, IV, CHN, espectroscopia eletrônica (UV-Vis), voltametria cíclica, ESI-MS.
PALAVRAS CHAVES: Complexos de ferro(III); ligante N3O doador; síntese e caracterização
INTRODUÇÃO: O ferro é um metal que atrai interesse especial pois é o mais abundante do organismo humano e está presente em uma série de processos e funções do sistema biológico como por exemplo, no metabolismo do oxigênio, no transporte de elétrons (fundamental na síntese de ATP) e em diversas enzimas com atividade oxirredutase (BARAN, 2005). Além disso, a química de coordenação do ferro é muito versátil devido a sua capacidade de aceitar ou doar elétrons interconvertendo-se entre a forma férrica e ferrosa, dependendo dos ligantes que se incorporam na sua coordenação (SATAKE e MIDO, 2006). Diante disso, a síntese e caracterização de complexos de ferro tem sido alvo de diversos trabalhos, pois existe a possibilidade de aplicação e desenvolvimento da química medicinal como nucleases artificiais e agentes quimioterápicos (GHOSH et al.,2012) antifúngicos, antitumorais, antimicrobianos (FERNANDES et al., 2006) e a sua possível aplicação como miméticos de enzimas com possibilidade de catálise em diversos processos de interesse tecnológico (AYALA e TORRES, 2004). A aplicação de compostos de ferro como catalisadores em reações de oxidação de hidrocarbonetos, atuando de forma mimética a Metano monoxigenase, se destaca como via de conversão de hidrocarbonetos em compostos de maior valor agregado, como álcoois e cetonas (COSTAS; CHEN; QUE Jr., 2000). Portanto, complexos de ferro vêm sendo estudados na pespectiva de aplicação como miméticos de sistemas biológicos e como compostos capazes de interagir com o DNA (GHOSH et al.,2012). Diante dessas possibilidades, esse trabalho apresenta a síntese e caracterização de um complexo de ferro(III), coordenado por um novo ligante N3O doador que pode ser avaliado posteriormente na perspectiva de alguma das linhas descritas anteriormente.
MATERIAL E MÉTODOS: O Ligante 3-[2-hidroxibenzil(2-piridilmetil)amino]propanoamida (L1) foi sintetizado em duas etapas (fig. 1): Primeiramente, reagiu-se 7,08 g (58 mmol) 2-hidroxi-benzaldeído com 6,30 g (58 mmol) de 2-aminometilpiridina em 50 mL de metanol, seguido de uma redução com 2,20 g de NaBH4 em banho de gelo. Após 24 h, o produto foi purificado por um processo de extração com diclorometano, resultando no N-(2-hidroxibenzil)-N-(piridin-2-ilmetil)amina (HBPA) (NEVES et al, 1995). Em seguida, reagiu-se 3,21 g (15 mmol) de HBPA com 1,06 g (15 mmol) de acrilamida em 50 mL de metanol sob banho de gelo durante 24 h. Após esse período, evaporou-se o solvente em um rotaevaporador obtendo-se um óleo castanho escuro, que passou por um processo de extração com diclorometano e lavagem da fase orgânica com água até que a fase aquosa se tornasse incolor. A fase orgânica foi seca com Na2SO4 anidro e o solvente removido sob pressão reduzida, resultando em 3,5828g de um óleo castanho claro (Rend. 83,74%). O ligante obtido foi caracterizado por espectroscopia de RMN de 1H e 13C e de IV. O complexo [FeIII(L1)Cℓ2] foi obtido pela mistura de 142,7 mg (0,5 mmol) do ligante L1 em 10 mL de diclorometano com 21 mg (0,5 mmol) de LiOH.H2O em 2 mL de acetonitrila, seguida da adição gota-a-gota de 135 mg (0,5 mmol) de FeCl3].6H2]O em 10 mL de de diclorometano, obtendo-se uma solução azul, que foi transferida para um balão e levada a um evaporador rotatório para evaporar cerca de 3/4 do solvente. Adicionou-se acetonitrila, formando-se um precipitado, que foi filtrado e após seco, resultou em 85 mg de um pó azul. Esse pó foi caracterizado por condutivimetria, IV, CHN, UV-Vis, voltametria cíclica, e ESI-MS.
RESULTADOS E DISCUSSÃO: O RMN de L1 (em CDCℓ3) apresentou sinais (em ppm) atribuídos como: 8,58–6,78 (8H de C-Haromático); 3,72 (2H, s; fenol-CH2N-); 3,88 (2H, s; -pirCH2N-); 2,87 (2H, t, J = 6,5Hz; -NCH2CH2C(=O)NH2); 2,40 (2H, t, J = 6,5Hz; -NCH2CH2C(=O)NH2); 157,5; 148,8; 137,3; 123,4; 122,7 (C pirid.); 157,2; 130,2; 129,5; 122,2; 119,3; 116,7 (C); 58,0 (pirid-CH2N-); 57,8 (fenol-CH2N-); 49,9(-NCH2CH2C(=O)NH2); 33,4 (-NCH2CH2C(=O)NH2); 174,1 (-NCH2CH2C(=O)NH2). O espectro de IV de L1 apresentou bandas correspondentes à estrutura: 3323, 3190 (NH2); 3014 (CHarom.); 2940, 2835 (CH2); 1667 (C=O); 1591, 1567, 1470, 1422 (C=C e C=N); 1113 (C-N). O IV do complexo (fig. 2) mostrou o deslocamento das bandas que foram observadas no IV de L1, indicando que ocorreu a coordenação do ligante com o metal Fe(III). O espectro do UV-Vis (fig. 2) apresenta uma banda de absorção pouco intensa em 276 nm, com ε de 1,0x104 L/.mol.cm, característica da transição π-π* do grupo piridina, uma banda em 359 nm com ε, aproximado, de 4,5x103 L/.mol.cm, atribuída à TCML do Cl para o metal e uma banda de absorção intensa em 578 nm, com valor de ε de 2,6x103 L/.mol.cm, atribuída à TCML fenolato-metal. A análise de CHN (%C = 42,14; %H = 4,42; %N = 9,21) aponta a formação de um composto mononuclear de ferro com o ligante desprotonado e dois íons cloreto com fórmula: [Fe(L1)Cℓ2]OH2.1/2CH2Cl2. A condutividade do complexo foi de 3,42 cm2/Ω.mol, coerente com composto não-eletrólito e indicando que o ligante foi desprotonado. A voltametria cíclica (fig. 2) confirma uma estrutura mononuclear, apresentando um processo redox Fe(III)/Fe(II) quasi reversível com ∆E de 225mV e um E½ de -0,137V (vs ENH). O ESI-MS (fig. 2) indicou fragmentos de massas que corroboram a estrutura do complexo.
Fig. 1
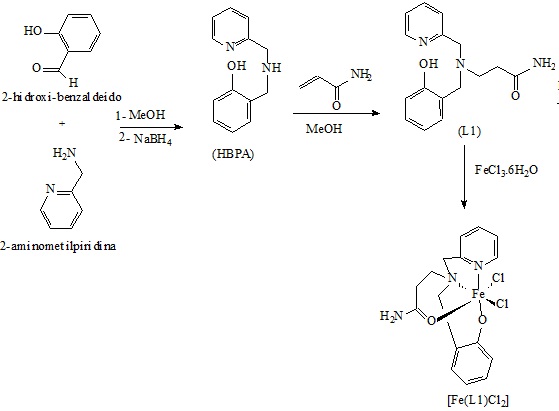
Rota sintética para a obtenção do ligante L1 e complexo [Fe(L1)Cl2]
Fig. 2
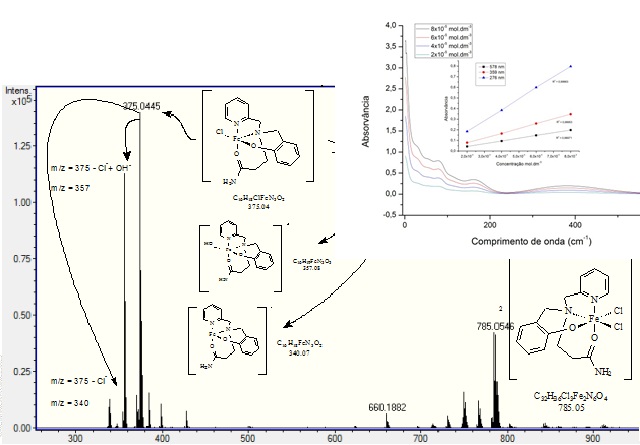
Espectro de ESI-MS e UV-Vis do complexo [FeIII(L1)Cl2]
CONCLUSÕES: As análises realizadas para a caracterização de L1 e complexo [FeIII(L1)Cℓ2] indicam os compostos foram obtidos. A análise de CHN, voltametria cíclica e ESI-MS suportam a proposta de um complexo com uma estrutura mononuclear resultante da coordenação do metal por uma unidade do ligante desprotonado com massa molar total de 453,85 g/mol. Desse modo, o complexo obtido pode ser usado em uma gama de testes posteriores citados anteriormente.
AGRADECIMENTOS: CNPq, FAPERJ, UENF e IFF
REFERÊNCIAS BIBLIOGRÁFICA: AYALA, M.; TORRES, E., Enzymatic activation of alkanes: constraints and prospective, Applied Catalysis A: General, vol. 272, p. 1–13, 2004.
BARAN, Enrique J. Suplementação de Elementos-Traços. Química Nova na Escola, n. 6, p. 7-12, jul. 2005.
COSTAS, M.; CHEN, K.; QUE Jr., L., Biomimetic Nonheme Iron Catalysts for Alkane Hidroxylation, Coordination Chemistry Reviews, vol. 200-202, p. 517-544, 2000.
FERNANDES, Christiane et al. Synthesis, crystal structure, nuclease and in vitro antitumor activities of a new mononuclear copper(II) complex containing atripodal N3O ligand. Inorganic Chimica Acta, v. 359, p. 3167–3176, 2006.
GHOSH, Kaushik et al. Efficient nuclease activity of dinuclear iron(III) complex with ligand having carboxamido nitrogen donors. Inorganic Chemistry Communications, v. 20, p. 167–171, 2012.
NEVES, A.; BRITO, M. A.; DRAGO, V.; GRIESAR, K.; HAASE, W., A new asymmetric N502-donor binucleating ligand and its first FeIIFeIII complex as a model for the redox properties of uteroferrin, Inorganica Chimica Acta, vol. 237, p. 131-135, 1995.
SATAKE, M.; MIDO, Y., Bioinorganic Chemistry, Discovery Publishing House, New Dheli, 2006.
