Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: ANÁLISE FÍSICO-QUÍMICA DE COMPRIMIDOS REVESTIDOS DE DICLOFENACO SÓDICO REFERÊNCIA, GENÉRICO E SIMILAR COMERCIALIZADOS NO MUNICÍPIO DE CARUARU-PE.
AUTORES: Mélo, Y.M.B.G. (FACULDADE ASCES) ; Aires, P.S.R. (FACULDADE ASCES) ; Assis, S.S. (FACULDADE ASCES) ; Souza, T.S. (FACULDADE ASCES) ; Silva, V.C. (FACULDADE ASCES) ; Silva, V.M. (FACULDADE ASCES) ; Lordão, D.C. (FACULDADE ASCES)
RESUMO: O controle de qualidade de medicamentos é de suma importância para garantir a
segurança e qualidade destes, visto que irregularidades podem ocasionar
alterações físico-químicas, organolépticas e comprometer na ação terapêutica dos
medicamentos. O presente trabalho tem como objetivo realizar análise físico-
química de comprimidos revestidos de Diclofenaco sódico referência, genérico e
similar, comercializados no município de Caruaru-PE, avaliando o diâmetro,
espessura, peso médio e desintegração, conforme descrito na Farmacopéia
Brasileira 5ª edição, e hermeticidade,conforme descrito na Farmacopéia dos
Estados Unidos Mexicanos 7ª edição. Os resultados obtidos mostraram que os
medicamentos A, B, E e F foram aprovados, e os medicamentos C, D e G foram
reprovados, no teste de desintegração.
PALAVRAS CHAVES: Análise físico-química; Comprimidos; Diclofenaco sódico
INTRODUÇÃO: Comprimidos são formas farmacêuticas sólidas geralmente preparadas com o auxílio
de adjuvantes farmacêuticos, podendo estes, variar em tamanho, forma, peso,
dureza, espessura, características de desintegração e dissolução e outros
aspectos, dependendo de sua finalidade de uso e seu método de fabricação (ANSEL,
2013). As formas farmacêuticas sólidas permitem a administração precisa da dose,
apresentam uma estabilidade superior e menor risco de contaminação
microbiológica quando comparadas às formas farmacêuticas líquidas (LACHMAN;
HANNA; LIN, 2001). O diclofenaco sódico é um anti-inflamatório não-esteroidal
(AINE), que possui ação antipirética, analgésica e anti-inflamatória, seus
principais efeitos terapêuticos derivam da sua capacidade de inibir a produção
de prostaglandina. A maioria dos AINES tem pouca seletividade e inibem
igualmente as ciclooxigenases (COX-1 e COX- 2), porém alguns outros como o
diclofenaco, mesmo sendo um AINE, exibem uma seletividade para COX- 2, o que
favorece uma diminuição de seu potencial ulcerogênico (GOODMAN E GILMANN, 2010).
Avaliações qualitativas e quantitativas das propriedades químicas e físicas dos
comprimidos devem ser realizadas para controlar a qualidade da produção
(LACHMAN; HANNA; LIN, 2001). Diante o exposto, o presente trabalho tem como
objetivo realizar análise físico-química de comprimidos de Diclofenaco sódico
referência, genérico e similar, comercializados no município de Caruaru-PE,
avaliando o diâmetro, espessura, peso médio e desintegração, conforme descrito
na Farmacopéia Brasileira 5ª edição, e hermeticidade conforme especificações da
Farmacopéia dos Estados Unidos Mexicanos 7ª edição.
MATERIAL E MÉTODOS: As amostras analisadas foram adquiridas em farmácias do município de Caruaru-PE,
contendo exclusivamente o diclofenaco sódico como princípio ativo, na
concentração de 50 mg. Para realização dos testes foram utilizadas 20 unidades
de cada amostra, cada teste foi realizado em triplicata. Sendo a amostra (A)
comprimidos do medicamento de referência, as amostras (B, C e D) dos
medicamentos genéricos e as amostras (E, F e G) dos medicamentos similares.
Foram realizados testes físico-químicos de diâmetro, espessura, peso médio e
desintegração, conforme especificações da Farmacopéia Brasileira 5ª edição, e
hermeticidade, conforme descrito na Farmacopéia dos Estados Unidos Mexicanos 7ª
edição. Os testes de diâmetro e espessura foram realizados através do paquímetro
- 150mm Digital Starrett, o peso médio através da balança Ohaus Adventurer Pró,
cabinada semi-analítica, onde foram pesados, individualmente, 20 comprimidos e
em seguida obteve-se a média. A desintegração foi realizada através do
desintegrador da marca Nova ética modelo 301-6, os comprimidos ficaram imersos
em soluções de ácido clorídrico a 0,1M durante 1 hora e subsequentemente em
tampão fosfato (pH 6,8) durante 45 minutos. A hermeticidade das embalagens foi
avaliada através da utilização de uma solução de azul de metileno contida em um
béquer, onde o blister de cada medicamento foi colocado sob uma pressão de 200
mmHg, durante 2 minutos, e em seguida foi observado se houve presença de
vazamento.
RESULTADOS E DISCUSSÃO: De acordo com os testes realizados,os valores obtidos para determinação do
diâmetro e espessura apresentaram variações mínimas, indicando uma boa
padronização na produção desses medicamentos. Os comprimidos A, C, E, F e G
apresentaram variações no peso médio de ± 7,5%e os comprimidos B e D de ± 5%,
indicando, que todos os comprimidos estavam dentro do limite especificado na
Farmacopéia Brasileira 5ª edição. No teste de desintegração, verificou-se que
os medicamentos A, B, E e F apresentaram resultado satisfatório, já os
medicamentos C, D e G apresentaram resultado insatisfatório, sendo este um
resultado importante, podendo vir a interferir na ação farmacológica do
medicamento. Um desvio de qualidade pode significar uma perda de eficácia ou de
segurança, expondo o paciente a um risco desnecessário (RIBEIRO, P. R, 2012).
Todos os medicamentos analisados (A, B, C, D, E, F e G), apresentaram resultado
satisfatório no teste de hermeticidade, ou seja, todas as embalagens estavam
hermeticamente fechadas, favorecendo a conservação e a proteção dos comprimidos
a fatores externos.
Resultado das análises físico-químicas
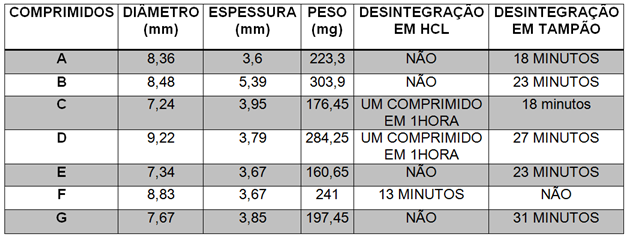
Análises físico-químicas dos comprimidos do
medicamento de referência(A), dos medicamentos
genéricos(B, C e D) e dos medicamentos
similares(E, F e G).
CONCLUSÕES: Dos medicamentos analisados, apenas os C, D e G foram reprovados no teste de
desintegração, resultado de bastante relevância, podendo vir a interferir na ação
farmacológica desses medicamentos. Porém, de acordo com o diâmetro, espessura,
peso médio e hermeticidade todos apresentaram resultado satisfatório.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ANSEL H. C.; POPOVIC NG & ALLEN JR LV Farmacotécnica: formas farmacêuticas e sistemas de liberação de fármacos. 9ª ed. São Paulo: Premier, 2013.
FARMACOPÉIA BRASILEIRA. 5. ed. 2010.
FARMACOPÉIA DOS ESTADOS UNIDOS MEXICANOS. 7. ed. 2000.
GOODMAN, L. S.; GILMAN, A. As bases farmacológicas da terapêutica. 11°. ed. Rio de Janeiro: Guanabara Koogan, 2010.
LACHMAN, L. LIEBERUAN, H. A.; KANIG, J. L. Teoria e prática na indústria farmacêutica. Lisboa: Fundação Calouse Gulben Kian, 2001.
RIBEIRO, P. R. controle de qualidade de medicamentos anti-hipertensivos similares comercializados em farmácias de imperatriz, MA, Brasil. Cad. Pesq., São Luís, v. 19, n. 1, jan./abr. 2012.
