Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: ESTUDO DE NOVOS SISTEMAS AQUOSOS BIFÁSICOS FORMADOS PELO COPOLÍMERO TRIBLOCO L64 E SAIS DE FOSFATO EM DIFERENTES TEMPERATURAS.
AUTORES: Nunes Faria, D. (UFES) ; Lima Nilo, P.H. (UFES) ; Siqueira da Silva, A. (UFES) ; S. do Nascimento, K. (UFC) ; Fuzer Mesquita, A. (UFES)
RESUMO: Sistemas aquosos bifásicos são sistemas constituídos majoritariamente por água,
polímeros e sais inorgânicos. Os materiais que compõem estes sistemas apresentam
vantagens se comparados aos solventes orgânicos utilizados nos processos de
extração/partição tradicionais, devido à baixa toxicidade associadas a eles.
Partindo disso, novos SABs constituídos pelo copolímero tribloco L64, tampão
KH2PO4/K2HPO4 (pH 7,00) e água foram construídos, e um estudo da influência da
temperatura nestes sistemas foi realizado. Com a redução da temperatura, um
pequeno aumento da área bifásica foi observado, indicando assim que o processo de
separação de fase tem um caráter exotérmico.
PALAVRAS CHAVES: Diagramas de fases; SABs; Copolímero tribloco
INTRODUÇÃO: Os sistemas aquosos bifásicos (SABs) podem ser empregados de forma eficiente em
técnicas extrativas envolvendo a separação, pré-concentração, determinação e
purificação de uma gama de materiais, dentre eles: fenóis, proteínas, organelas
celulares, membranas, proteínas, corantes e íons metálicos. São formados por
misturas aquosas entre dois polímeros estruturalmente diferentes ou uma solução
de polímero e outra salina, alternativamente, existem trabalhos demonstrando as
potencialidades dos líquido iônicos em substituição aos polímeros na formação de
SABs para extração de testosterona, proteínas e alcaloides.1-4
Embora os sistemas polímero + sal apresentarem vantagens como baixo custo dos
materiais, baixa viscosidade e tempo relativamente baixo na separação das fases,
os sistemas formados por polímeros mais simples apresentam dificuldades no
isolamento de biomateriais a partir das fases poliméricas.5 Desta forma, um SAB
alternativo foi estudado visando aprimorar a separação e o custo de recuperação
do polímero. Os sistemas estudados possuem em sua composição um polímero
termossensível6 que separa de fase a partir de pequenas mudanças de temperatura.
Neste trabalho foram determinados os diagramas de fase de sistemas formados pelo
copolímero tribloco L64, o tampão KH2PO4/K2HPO4 (pH 7,00) e água nas
temperaturas de 25, 15 e 5 °C com posterior avaliação da influência da
temperatura na formação destes sistemas.
MATERIAL E MÉTODOS: Foi determinado o diagrama de fase com Pluronic® L64, copolímero de bloco
comprado da Sigma-Aldrich , com Mn = 2900 g/mol e 40% em massa de PEO. Para o
tampão foram utilizados os sais PA fosfato de potássio dibásico anidro (K2HPO4),
M=174,18 g/mol, e fosfato monobásico de potássio (KH2PO4) em pó, M=136,09 g/mol,
ambos da marca Amresco®. O sais foram utilizados sem purificação adicional.
Todos os experimentos foram feitos com água deionizada.
Para o desenvolvimento da pesquisa, foram utilizados soluções estoque a 40%
(m/m) do copolímero tribloco L64 , e solução estoque do tampão KH2PO4/K2HPO4 (pH
7,00) a 30%(m/m). Para a construção do diagrama de fase por titulação
turbidimétrica, foram pesados em um tubo de ensaio cerca de 1 grama da solução
do L64 (40% m/m). Este sistema foi inserido em um banho termostatizado a 15 °C,
ao qual foram inseridos alíquotas discretas de 25 microlitros do tampão de
fosfato pH 7,00 (30% m/m) até a turvação. Após o repouso e formação de duas
fases, foi anotada a composição final, e adicionados 100 microlitros de água
continuamente, até a homogeneização do sistema. A 25 e 5 °C, o procedimento foi
análogo. Para a construção das linhas de amarração, foram determinadas as
concentrações de cada componente nas fases. O sal (tampão) foi determinado por
condutivimetria, o L64 foi determinado pelo índice de refração total da fase (à
temperatura de trabalho de 26 °C) e subtraído do valor encontrado para o sal. A
porcentagem em massa da água foi determinada pela diferença entre a porcentagem
em massa de cada componente em relação à porcentagem em massa total (wt=1,00).
RESULTADOS E DISCUSSÃO: Os diagramas de fase foram levantados a partir das análises das fases por
condutivimetria e refratometria. Na Figura 1 (a e b) observa-se o efeito da
temperatura no processo de separação de fase. Pelos diagramas, é possível
observar que a redução da temperatura provoca um pequeno aumento da área
bifásica, indicando assim que o processo de separação de fase tem um caráter
exotérmico 6.
Corroborando a análise gráfica, a influência da temperatura pode ser estimada
pelo cálculo da inclinação da linha de amarração (ILA), parâmetro que demonstra
a variação da composição das fases mediante a alteração da temperatura. Os
valores são determinados a partir da razão entre a diferença das concentrações
do polímero e a do sal, ambos na fase superior (FS) e fase inferior (FI).
Observa-se que um aumento da temperatura provoca um aumento na ILA. Uma possível
explicação para esta variação é a difusão espontânea de água da FS para FI em
temperaturas elevadas, aumentando a concentração do L64 na fase superior e uma
redução na concentração do sal na fase inferior.
Figura 1 (a). Diagramas de fase e efeito da temperatura nos SABs.
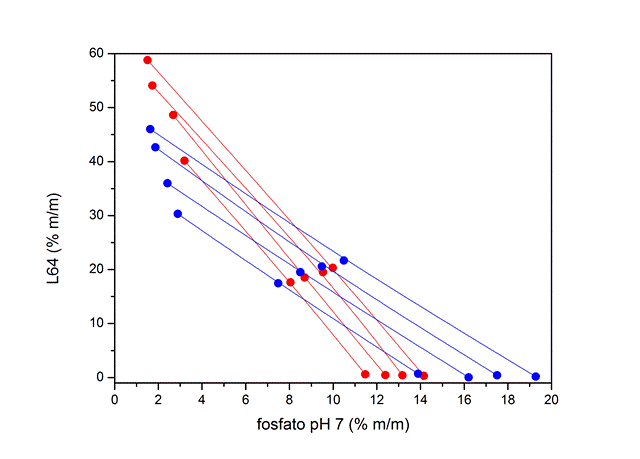
Em (a) SABs a 25 (vermelho) e 5 (azul) °C.
Figura 1 (b). Diagramas de fase e efeito da temperatura nos SABs.
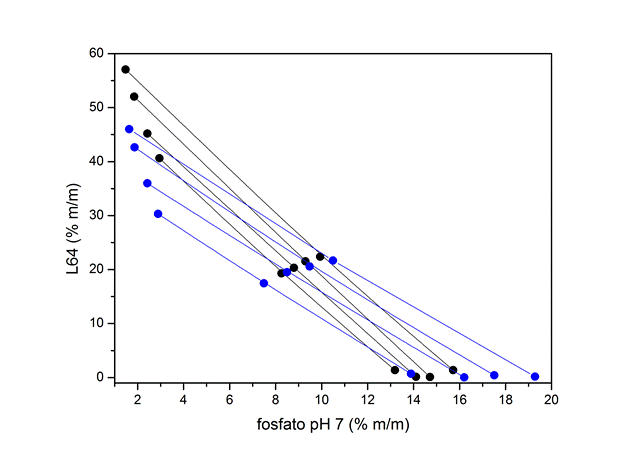
Em (b) SABs a 15 (preto) e 5 (azul) °C.
CONCLUSÕES: Os resultados mostram que o processo de separação de fase é exotérmico, havendo o
aumento da área bifásica à medida que se reduz a temperatura. A temperatura
influencia na composição das fases comprovado pelos valores de ILA, versando sobre
o transporte espontâneo de água entre as fases.
AGRADECIMENTOS: Ao PIIC/UFES, FAPES, CAPES e ao Núcleo de Competências em Química do Petróleo
(NCQP)/Petrobrás/UFES pelo auxílio financeiro e de infraestrutura.
REFERÊNCIAS BIBLIOGRÁFICA: 1. Rodrigues, G. D.; da Silva, L. H. M. et al. J. Chem. Eng. Data, 2010, 55, 1158-1165.
2. He, C.; Li, S.; Liu, H.; Li, K.; Liu, F. J. Chromatogr. A 2005, 1082, 143–149.
3. Du, Z.; Yu, Y.; Wang, J. Chem.sEur. J. 2007, 13, 2130–2137
4. Li, S.; He, C.; Liu, H.; Li, K.; Liu, F. J. Chromatogr., B 2005, 826, 58–62
5. da Silva, L. H. M; da Silva, M. C. H; Mesquita, A. F.; Nascimento, K. S.; Coimbra, J. S.; Minim, L. A. J. Chem. Eng. Data, 2005, 50, 1457-1461.
6. Rodrigues, G. D.; da Silva, M. C. H.; da Silva, L. H. M.; Teixeira, L. S.; Andrade, V. M. J. Chem. Eng. Data, 2009, 54, 1894-1898.
