Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: Estudo de propriedades físico-químicas e derivação do padrão farmacofórico para compostos pertences a classe de cefalosporinas.
AUTORES: Picanço, L.C.S. (UNIFAP) ; Henriques, S.V.C. (UNIFAP) ; Medeiros, A.F. (UNIFAP) ; Alves, C.M. (UNIFAP) ; Santos, C.B.R. (UNIFAP) ; Hage-melim, L.I.S. (UNIFAP)
RESUMO: As cefalosporinas apresentam grande importância clínica, pois é o grupo de antimicrobianos mais prescritos no mundo. O objetivo deste estudo foi analisar as propriedades físico-químicas associados com a Regra dos Cinco de Lipinski e derivação do padrão farmacofórico para compostos pertencentes à classe de cefalosporinas. Este estudo analisou 26 inibidores da enzima β-lactamase, sendo observado que apenas um composto apresenta valores maiores de peso molecular, número de aceptores de hidrogênio e lipofilicidade violando a regra. O padrão farmacofórico derivado aos inibidores selecionados apresentou três grupos aceptores de ligação de hidrogênio e um grupamento aromático. Os resultados mostram que 25 dos vinte e seis inibidores são potenciais candidatos a fármacos.
PALAVRAS CHAVES: Cefalosporinas; Antimicrobianos; Novos fármacos
INTRODUÇÃO: De 1960 a 1980 foram introduzidos no mercado antibióticos semi-sintéticos eficazes contra Gram-positivos e Gram negativos, análogos aos antibióticos naturais existentes. No período entre 1980-2000 houve uma redução dramática na identificação de protótipos antibióticos, ao mesmo tempo em que ocorreu um aumento na incidência de resistência bacteriana (GUIMARÃES, 2010).
O aumento da resistência bacteriana a vários agentes antimicrobianos acarreta em dificuldades no manejo de infecções e contribui para o aumento de custos do sistema de saúde e dos próprios hospitais (CASTRO, 2002). Nos países em desenvolvimento, poucos recursos são empregados na monitorização de ações sobre o uso racional de antibióticos o que resulta em um uso desenfreado de antibióticos sem uma cuidadosa avaliação das suas indicações apropriadas, o que pode levar ao crescimento de cepas resistentes, ou seja, acarretar em uma mutação seletiva (NICOLLINI, 2008).
Há uma necessidade permanente de novos antibióticos. Dois fatores agravam este problema de desestímulos para desenvolvimento de antibióticos: Os antibióticos são usados em quantidades menores quando comparados com as drogas de uso crônico; e a utilização dos antibióticos recentemente aprovados é limitado apenas no tratamento de infecções bacterianas graves. O resultado é que a resistência está em ascensão enquanto a descoberta e o desenvolvimento está em declínio (FISCHBACH, 2009).
MATERIAL E MÉTODOS: A busca por inibidores foi realizadas no banco de dados BindingDB onde foram selecionados 26 inibidores. Parâmetros estruturais relevantes disponíveis no BindingDB, como número de aceptores e doadores de ligação de hidrogênio e peso molecular, foram selecionados para a análise teórica dos perfis de biodisponibilidade oral. As estruturas das moléculas então foram otimizadas com menor energia utilizando o programa HyperChem e a conformação mais estável de cada molécula foi utilizada para os cálculos seguintes. Dois fármacos estruturalmente semelhantes, porém distintos quanto suas propriedades físico-químicas, podem apresentar resposta biológica diversa.Os estudos de propriedades físico-químicas relacionadas aos parâmetros da Regra dos cinco (RO5) de Lipinski et al. (1997) foram realizadas utilizando dados do banco de dados e utilizando o programa HyperChem. Em seguida, uma padrão farmacofórico comum aos inibidores selecionados foi derivado utilizando o servidor PharmaGist (SCHNEIDMAN-DUHOVNY et al., 2008). Os farmacóforos candidatos foram detectados por alinhamento flexível múltiplo dos ligantes utilizados.
RESULTADOS E DISCUSSÃO: Segundo Lipinski et al. (1997), um fármaco para ter boa biodisponibilidade oral deve satisfazer os seguintes parâmetros: Peso molecular menor do que 500 daltons; LogP menor do que 5; Máximo de cinco grupos doadores de ligação hidrogênio; Máximo de dez grupos aceptores de ligação hidrogênio. Essa condição ficou conhecida como “Regra dos Cinco”, porque para cada um dos quatro parâmetros, os valores encontrados eram próximos a cinco ou múltiplos de cinco (LIPINSKI, 2004). Os dados para avaliação da “Regra dos Cinco” de todos os compostos pertencentes à classe de cefalosporinas podem ser observados na Tabela 1. Ao analisar os parâmetros dos compostos selecionados, pode-se observar que apenas o composto 13 apresenta valores maiores de peso molecular, número de aceptores de hidrogênio e lipofilicidade (peso molecular = 563,39; HBA = 12; logP = 5,28, respectivamente) que a regra dos Cinco preconiza.
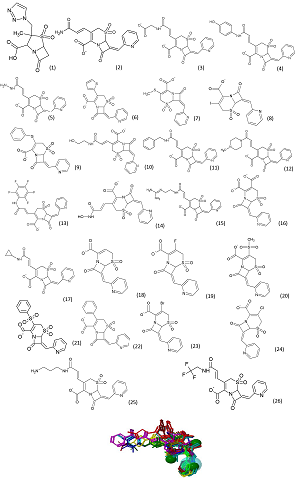
Predizer interações moleculares é o objetivo primordial da estratégia “análogo ativo” em planejamento racional de fármacos. Um modelo importante para alcançar este objetivo é o farmacóforo (DROR et al., 2004). O padrão farmacofórico derivado aos inibidores selecionados apresentou três grupos aceptores de ligação de hidrogênio e um grupamento aromático. O farmacóforo dos inibidores encontra-se na posição 7 do núcleo cefem. A presença de anel aminotiazólico nessa posição das cefalosporinas aumenta a penetração do antibiótico através da membrana externa das bactérias Gram negativa e pode também aumentar a afinidade pela a enzima transpeptidase (GUIMARÃES et al, 2010; RIVAZ et al, 2002; MELLA, 2001).
Tabela 1
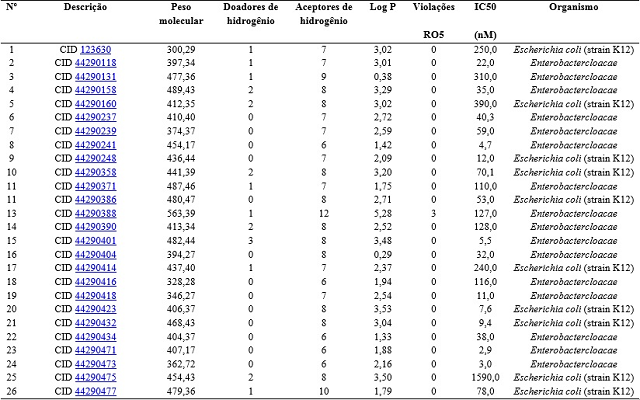
Propriedades físico-químicas relacionadas à Regra dos Cinco para os compostos selecionados.
Figura 1. A) Estruturas químicas dos 26 compostos selecionados a parti
CONCLUSÕES: Devido a grande importância clínica das cefalosporinas, faz-se necessário a busca por novos fármacos. Os resultados obtidos mostram que 25 inibidores apresentam os parâmetros físico-químicos respeitando a Regra dos Cinco de Lipinski. O padrão farmacofórico derivado apresentou três grupos aceptores de ligação de hidrogênio e um grupamento aromático. O farmacóforo encontra-se na posição 7 do núcleo cefem, responsável principalmente pela penetração do antibiótico pela membrana externa das bactérias Gram negativa. Os resultados mostram que esses 25 inibidores são potenciais candidatos a fármacos.
AGRADECIMENTOS: À Universidade Federal do Amapá (UNIFAP)
Ao Laboratório de Modelagem e Química Computacional (LMQC)
REFERÊNCIAS BIBLIOGRÁFICA: CASTRO, M. S.; et al. Tendências Na Utilização De Antimicrobianos Em Um Hospital Universitário, 1990-1996. Revista de Sáude Pública. v.36. nº5, p.553:558, 2002.
DROR, O.; SHULMAN-PELEG, A.; NUSSINOV, R.; WOLFSON, H. J.; Predicting molecular interactions in silico: I. A guide to pharmacophore identification and its applications to drug desing. Current Medicinal Chemistry, V. 11, nº1, p. 71-90, 2004.
FISCHBACH, M. A.; WALSH, C. T. Antibiotics for EmerginPathogens. Science.V.28. nº5944. 1089:1093, 2009. Disponível em: http://www.sciencemag.org.sci-hub.org/content/325/5944/1089.full
GUIMARÃES, D. O. et al. Antibióticos: Importância Terapêutica e Perspectivas para a Descoberta e Desenvolvimento de Novos Agentes. Química Nova, V.33, n.3,667:679, 2010.
LIPINSKI, C. A.; LOMBARDO, F.; DOMINY, B. W.; FEENEY, P. J. Experimental and computational approaches to estimate solubility and permeabitity in drug Discovery and development settings. Advanced Drug Delivery Reviews, V. 23, p.3-25, 1997.
LIPINSKI, C.A. Lead and drug-like compounds: the rule-of-five revolution. Drug Discovery Today: Technologies, V.1, p.337-341, 2004.
MELLA, S. M.; et al. Propiedades microbiológicas, clasificación y relación estructura-actividad de cefalosporinas e importanciade las cefalosporinas de cuarta generación. Revista Chilena de Infectologia, v. 18, n. 1, 7:9, 2001.
NICOLLINI, P.; NASCIMENTO, J. W. L.; GRECO, K.V., DE MENEZES, F. G.Fatores relacionados à prescrição médica de antibióticosem farmácia pública da região Oeste da cidade de São Paulo.Ciência& Saúde Coletiva, v.13(Sup), 689:696, 2008.
RIVAZ, K.B.; et al. Cefalosporinas. De laprimera a lacuartageneración. Revista de laFacultad de Medicina. v. 25, n.2, 2002.
SCHNEIDMAN-DUHOVNY, D.; DROR, O.; INBAR, Y.; NUSSINOV, R.; WOLFSON, H. J. PharmaGist: a webserver for ligand-based pharmacophore detection. Nucleic Acids Research, V. 36, p. W223-W228, 2008.
