Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: Avaliação da resposta eletroquímica da trifluralina utilizando voltametria de onda quadrada e eletrodo de carbono vítreo.
AUTORES: Santos, A.M. (UEMS) ; Siara, L.R. (UEMS) ; Arruda, G.J. (UEMS)
RESUMO: Este trabalho apresenta a avaliação da resposta eletroquímica da trifluralina
utilizando os seguintes eletrólitos de suporte: H2SO4(pH
2,0), BR (pH 6,0),
Na2PO4/C6H8O7(pH 6,0) ,
NaOH (pH 12,0), todos com concentração de 0,02 mol L-1e a voltametria
de onda quadrada (SWV) como método eletroquímico e eletrodo de trabalho o
eletrodo de carbono vítreo. Os resultados obtidos mostraram que o eletrólito
afeta o potencial e a corrente de pico de redução da trifluralina. Observou-se
que a intensidade de pico de redução é em meio ácido 3,2 vezes maior que em meio
básico e 5,7 vezes maior que em tampão BR e 4 vezes maior que o tampão fosfato.
PALAVRAS CHAVES: Trifluralina; Carbono vítreo; SWV
INTRODUÇÃO: A trifluralina é um herbicida pré-emergente de nome químico α,α,α-trifluoro-2,6-
dinitro-N,N-dipropil-p-toluidina pertencente ao grupo das dinitroanilinas, é
indicado para o controle de ervas daninhas em uma ampla variedade de culturas
agrícolas sendo considerado mediamente tóxico (ANVISA, 2010). A voltametria é um
método de análise baseado nos princípios da eletroquímica que avalia processos
químicos provocados pela transferência de elétrons em eletrodos, esse método é
mais viável que os métodos de cromatografia gasosa e espectroscopia de absorção
devido a utilização de aparelhos simples, precisos e de custo acessível (MOSES,
P. R., et al., 1822). A voltametria de onda quadrada (SWV) é uma
técnica eletroquímica sensível em que os limites de detecção podem ser
comparados aos das técnicas cromatográficas e espectroscópicas (Avaca et
al., 2003). Este trabalho tem como objetivo avaliar a influência do
eletrólito de suporte sobre a corrente e potencial de pico de redução da
trifluralina utilizando SWV como método eletroquímico e eletrodo de carbono
vítreo como eletrodo de trabalho.
MATERIAL E MÉTODOS: As medidas eletroquímicas foram realizadas em um Potenciostato/Galvanostato
AUTOLAB PGSTAT-12 interfaciado a um computador e gerenciado pelo software GPES
4.9 para aquisição dos dados. Para as medidas e ajuste dos valores de pH
utilizou-se um pHmetro HANNA Instruments HI 3221. Uma célula eletroquímica com
três eletrodos e capacidade de 25 mL foi utilizado para as medidas
eletroquímicas. Os eletrodos de fio de platina, prata/cloreto de prata (Ag/AgCl)
e eletrodo de carbono vítreo com área geométrica de 4,26 mm2, foram
utilizados como eletrodo auxiliar, referência e de trabalho, respectivamente. Os
voltamogramas foram obtidos após 10 minutos de purga de nitrogênio com 99,999%
de pureza. Reagentes: A solução estoque de trifluralina foi preparada através da
diluição do padrão analítico (Sigma - Aldric) com 99,1% de pureza em etanol
absoluto (99,8%). Foram utilizados quatro tipos de eletrólitos de suporte: 1) BR
(Britton-Robinson pH 6,0; 0,02 mol L-1), sendo este ajustado com uma
solução de NaOH (0,2 mol L-1). 2)
Na2PO4/C6H8O7(pH 6,0;
0,02 mol L-1). 3) H2SO4 (pH 2,0; 0,02 mol
L-1). 4) NaOH (pH 12,0; 0,02 mol L-1). Para as medidas
eletroquímicas foram adicionados em 5 mL do eletrólito suporte quantidade
suficiente para obter uma concentração de 150 x 10-6 mol
L-1 de trifluralina na célula.
RESULTADOS E DISCUSSÃO: Os voltamogramas de onda quadrada obtidos estão apresentados (Figura 1) para
todos os eletrólitos com e sem adição de trifluralina. Observa-se a ausência de
pico nos voltamogramas obtidos para todos os eletrólitos avaliados
(voltamogramas 1 Figura 1A, 1B, 1C e 1D). A presença da trifluralina na célula
eletroquímica provocou o aparecimento de um pico de redução em potencial de
aproximadamente -0,8V. O eletrólito de suporte provoca um deslocamento do
potencial de pico para valores mais positivos quando o pH do meio é deslocado
para valores menores (pH ácido, Tabela 1). A intensidade do pico de redução
também é influenciada pelo pH do eletrólito de suporte, conforme pode ser
observado na Tabela 1 a intensidade de pico em H2SO4 é 5,7
vezes maior que o BR, 3,2 vezes maior que NaOH e 4 vezes maior que
Na2PO4/C6H8O7. O aumento
na intensidade do pico de redução da trifluralina em meio ácido pode ser
atribuído a densidade eletrônica formada pela presença de grupos nitros
protonados e a presença do grupo eletrofílico trifluorometilo na molécula de
trifluralina, que favorece a redução dos dois grupos nitros que acontece quase
simultaneamente (KOTOUCEK, M. et al., 1996). Para fins analíticos
com o propósito de determinar eletroquimicamente a trifluralina o meio ácido é o
mais indicado, pois fornece uma maior intensidade na corrente de pico de
redução.
Figura 1
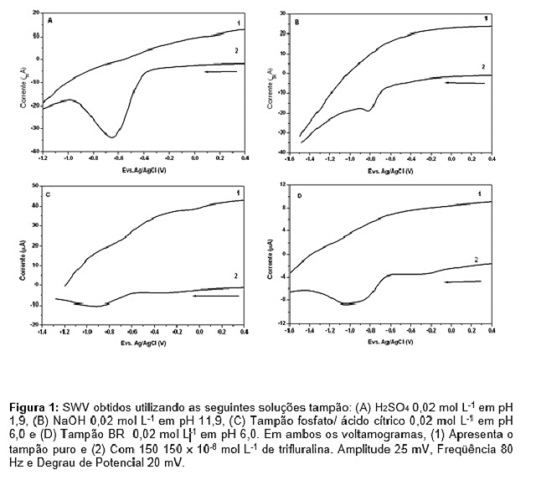
Figura 2

CONCLUSÕES: Os resultados obtidos mostraram que o pico de redução da trifluralina é fortemente
influenciado pelo meio e sugere que o meio ácido é o mais indicado para
desenvolvimento de metodologia eletroquímica para quantificar a trifluralina.
AGRADECIMENTOS: UEMS, CNPq e Fundect.
REFERÊNCIAS BIBLIOGRÁFICA: VACA, A. L.; SAOUZA, D.; MACHADO A. S.; "Voltametria de onda quadrada. primeira parte: aspectos teóricos" Química Nova , 26. 1. 2003.
ANVISA, Agência Nacional de Vigilância Sanitária. Resolução RE nº 159 de 19/01/10 índice monográfico T 24. Disponível em: http://portal.anvisa.gov.br/wps/wcm/connect/cf3ae9804745896f93a5d73fbc4c6735/T24++Trifluralina.pdf?MOD=AJPERES
KOTOUCEK, M.; OPRAVILOVA, M. 1996. Voltammetric behaviour of some nitropesticides at the mercury drop electrode. Analytica Chimica Acta. 329: 73-81 MOSES, P. R., Wier, L., Murray R. W. "Chemically Modified tin oxide Eletrocde" Anal. Chem.1975 (47), 1822.
