Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: Capacidade adsortiva e influência do pH no comportamento eletroquímica do complexo Cr(VI)-alizarina adsorvido na superfície do eletrodo de grafite pirolítico (edge)
AUTORES: Furtado, N.J.S. (UFPI) ; Farias, E.A.O. (UFPI) ; Silva, J.P.R. (IFPI) ; Lima Neto, S.M. (IFPI) ; Silva, J.B. (IFPI) ; Magalhães, J.L. (UFPI) ; Eiras, C. (UFPI) ; Leite, J.R.S.A. (UFPI)
RESUMO: O objetivo deste estudo foi verificar a capacidade adsortiva do complexo Cr(VI)-
alizarina (Cr(VI)-alz), e a influência do pH na resposta eletroquímica do
eletrodo de grafite pirolítico plano edge (EGP-edge) modificado pelo Cr(VI)-alz.
Considerando 40 s o tempo de imersão, a relação linear entre corrente de pico
versus velocidade de varredura confirmou a presença de um processo adsortivo
para o complexo metálico. Obteve-se melhores resoluções em pH 6,52, havendo
deslocamento de potencial para lado negativo com o aumento de pH. O pH 6,52 será
o pH de estudo para uma posterior quantificação (voltametria de redissolução) do
íon Cr(VI) em matrizes de interesse ambiental.
PALAVRAS CHAVES: Complexo Cr(VI)-alizarina; Caracterização; Grafite Pirolítico edge
INTRODUÇÃO: O corante alizarina (alz) (1,2-dihidróxi-9,10-antraquinona) é caracterizado pela
presença de duas hidroxilas ligadas à estrutura central de uma antraquinona. As
propriedades complexantes da alizarina são as responsáveis por sua larga
aplicabilidade na determinação de metais associados a diversas técnicas
analíticas, tais como: espectrofotometria, polarografia, voltametria e
cromatografia. O poder de complexação da alizarina está relacionado à presença
do grupo paraquinona e de suas hidroxilas, através dos quais os íons metálicos
presentes em solução podem ser complexados e pré-concentrados na superfície do
eletrodo (FERNANDES, 1998). A literatura mostra aplicações de eletrodos de
grafite pirolítico para fins analíticos, isto se deve ao aumento da
sensibilidade devido à adsorção espontânea de espécies químicas que modificam
quimicamente a superfície desses eletrodos gerando os eletrodos quimicamente
modificados (EQM). Estes eletrodos são largamente utilizados para evidenciar
diversos íons metálicos (ex: Cu(II), Cu(I), Al(III), Fe(III) e etc.) em meio
aquoso, isto é possível com o estudo de especiação desses complexos na
superfície do eletrodo. Na caracterização eletroquímica de complexos metálicos
adsorvidos na superfície de eletrodos sólidos, parâmetro, tais como: pH e
capacidade adsortiva, são importantes para compreensão dos processos
eletroquímicos estudados. Até o momento não existem discussões na literatura
sobre o comportamento eletroquímico do Cr(VI)-alz em EGP-edge, e isto motivou a
realização do presente estudo. Sobre essas bases, este trabalho teve como
objetivo verificar a capacidade adsortiva do Cr(VI)-alz, e a influência do pH na
resposta eletroquímica do EGP-edge modificado por esse complexo metálico.
MATERIAL E MÉTODOS: As medidas de voltametria cíclica foram realizadas no Potenciostat/Galvanostato
Autolab PGSTAT 128N, acoplado a um computador com o software Nova 1.6 para
obtenção dos voltamogramas. Realizou-se os experimentos em célula eletroquímica
de 50,0 mL, onde adicionou-se na mesma 20 mL de tampão Britton Robisson (BR). A
célula continha entradas para eletrodos de referência (calomelano saturado), de
trabalho (EGP-edge), auxiliar (fio de platina. Entende-se como plano edge o
corte do grafite pirolítico de forma perpendicular ao plano basal. Para
compreender o comportamento do complexo Cr(VI)-alz adsorvido na superfície do
eletrodo foram estudados dois parâmetros nos experimentos eletroquímicos:
capacidade adsortiva e influência do pH. Os estudos foram realizados em meio
aquoso, primeiramente, houve a modificação da superfície do EGP-edge com
alizarina. Esta modificação foi obtida com a imersão do EGP-edge na solução
aquosa (1x10-3 mol L-1) de alizarina por 40 s, sobre agitação mecânica, após
isto o eletrodo foi ciclado, retirado da célula e imerso por 40 s numa solução
ácida de K2Cr2O7 a 1x10-2 mol L-1. No teste de capacidade adsortiva os registros
dos voltamogramas cíclicos foram obtidos em pH 6,52 nas velocidades de
varreduras de 50, 100, 150, 200 e 250 mV s-1. O pH do tampão BR foi ajustado com
a adição da solução de NaOH (1,0 mol L-1) gota a gota até alcançar os pHs 5,1,
5,3, 5,62, 5,90 e 6,52, onde foi avaliada a influência desses pHs no
comportamento eletroquímico do Cr(VI)-alz.
RESULTADOS E DISCUSSÃO: O Cr(VI)-alz apresentou capacidade adsortiva característica, pois o aumento da
velocidade de varredura (v) foi proporcional ao aumento da corrente de pico
(ip), como pode ser observado na Figura 1. O complexo Cr(VI)-alz fica adsorvido
na superfície do EGP-edge por um processo de adsorção, encontrou-se uma relação
linear com R2 = 0,9997 para corrente de pico da onda II, e de 0,9453 para
corrente de pico da onda II’. Nesta situação, a relação ip x v é mais linear
para corrente de pico anódica do que para corrente de pico catódica, mostrando
que a onda anódica mesmo em altas velocidades de varredura não apresenta desvio
da linearidade que seria decorrente de um processo de dessorção, no qual o
complexo formado seria retirado da superfície do EGP-edge para a solução,
causando um processo difusional (FERNANDES, 1998; MOUCHREK FILHO et al., 1999).
Os processos redox do complexo Cr(VI)-alz foram dependentes do pH do meio. Em pH
5,90 uma onda anódica (-0,029 V) e catódica (-0,231 V) foram mais bem definida
do que nos pHs anteriores. A medida que o pH aumenta os processos redox vão
sofrendo melhor definição até alcançar um máximo em pH 6,52 (Figura 2), onde as
ondas anódica e catódica corresponderam a respectivamente: -0,033 V e -0,326 V.
O aumento do pH provocou um deslocamento de potencial para o lado mais catódico,
conforme esperado teoricamente para espécies químicas eletroativas que obedece a
equação de Nernst (BARD; FAULKNER, 2001). Em pHs abaixo de 5,10 há alguma forma
de competição entre os íons Cr(VI) e H+ pelos elétrons livres dos dois grupos
hidroxilas do ligante alizarina, este mecanismo impede a formação das ondas
voltamétricas (II e II’). Já em pHs maiores do que 6,52 há precipitação do
metal na forma de seu hidróxido metálico.
Figura 1
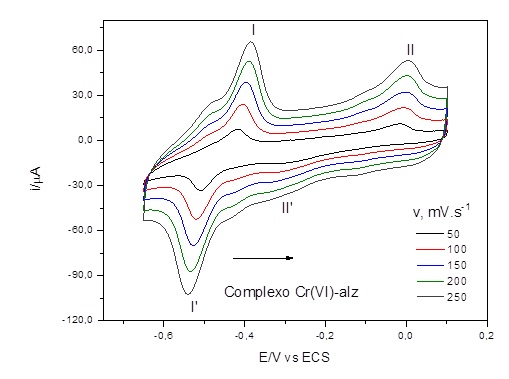
Voltamogramas cíclicos da capacidade adsortiva do
Cr(VI)-alz em EGP-edge (0,172 cm2), tampão BR pH
6,52 em diferentes velocidades de varreduras
Figura 2
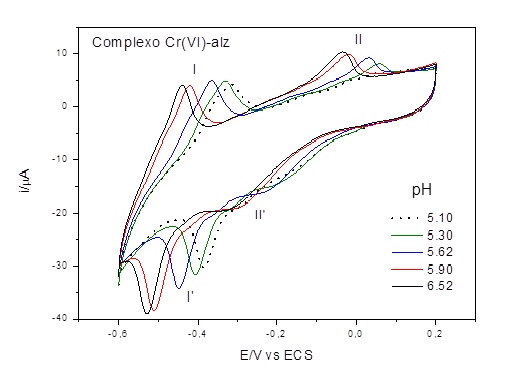
Voltamogramas cíclicos do complexo Cr (VI)-alz em
diferentes valores de pH, obtidos em Tampão BR, v =
50 mV s-1
CONCLUSÕES: A relação linear entre ip x v confirma que o Cr(VI)-alz adsorve na superfície do
EGP-edge por um fenômeno de adsorção. O pH influência os processo redox do
complexo metálico, sendo a melhor resolução dos processos eletroquímicos obtida em
pH 6,52. O aumento de pH mostra que o complexo Cr(VI)-alz obedece a equação de
Nernst, com deslocamento de potencial para o lado negativo. O pH de 6,52 é próximo
ao da água proveniente de efluentes líquido de curtumes, mostrando que esse deve
ser o pH utilizado na posterior determinação do Cr(VI) com as técnicas de
voltametria de redissolução.
AGRADECIMENTOS: Ao IFPI, UFPI e ao Grupo BIOTEC
REFERÊNCIAS BIBLIOGRÁFICA: BARD, A. J.; FAULKNER, L. R. Electrochemical methods, fundamentals and applications. John Wiley and Sons; New York, 2001.
FERNANDES, E. N. Estudo comparativo de algumas alizarinas por voltametria e espectrofotometria. 1998. 87 f. Dissertação (Mestrado em Química) – Universidade Federal do Maranhão, São Luis, 1998.
MOUCHREK FILHO, V. E.; MARQUES, A. L. B.; ZHANG, J. J.;CHIERICE, G. O. Surface Complexation of Copper(II) with Alizarin Red S Adsorbed on a Graphite Electrode and Its Possible Application in Electroanalysis. Electroanalysis, vol. 11, n° 15, p. 1130-1136, 1999.
