Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Físico-Química
TÍTULO: A influência do pH e potencial formal do eletrodo de grafite pirolítico (edge) modificado com o ligante alizarina
AUTORES: Furtado, N.J.S. (UFPI) ; Farias, E.A.O. (UFPI) ; Santos, T.D. (IFPI) ; Silva, J.C. (IFPI) ; Silva, J.B. (IFPI) ; Magalhães, J.L. (UFPI) ; Eiras, C. (UFPI) ; Leite, J.R.S.A. (UFPI)
RESUMO: O objetivo deste estudo foi verificar a influência do pH e potencial formal do
eletrodo de grafite pirolítico plano edge (EGP-edge) modificado com o corante
alizarina. Considerando 40 s o tempo de imersão, o comportamento eletroquímico do
ligante alizarina foi avaliado nos pHs 2.06; 3.60; 5.10; 6.52; 8,06 e 9,45. Em pH
abaixo de 5, a alizarina apresentou duas oxidação e uma redução, onde o aumento do
pH causou um deslocamento de potencial para o lado negativo. O grupo paraquinona
do ligante alizarina é o responsável por seu processo redox, onde o potencial
formal de -48 mV pH-1 garante no processo eletroquímico de redução reversível da
alizarina o envolvimento de dois prótons e dois elétrons.
PALAVRAS CHAVES: Alizarina; Potencial Formal; Grafite Pirolítico edge
INTRODUÇÃO: As alizarinas são um classe de corantes que apresentam cores fortes, tais como:
amarelo, alaranjado, vermelho, azul, verde e etc. Elas destacam-se como
indicadores ácido-base, onde suas soluções exibem diferentes colorações
dependendo do pH do meio. Pertencendo a essa classe de corantes, a alizarina
(alz) (1,2-dihidróxi-9,10-antraquinona) é caracterizada pela presença de duas
hidroxilas ligadas à estrutura central de uma antraquinona. Existem estudos na
literatura que discutem seu uso como agente modificador da superfície de
eletrodos sólidos, e estes uma vez modificados foram aplicados para determinar
metais em meios aquosos, isto empregando técnicas analíticas de voltametria
(FERNANDES, 1998). A literatura mostra diversas aplicações de eletrodos de
grafite pirolítico para fins analíticos, isto se deve ao aumento da
sensibilidade devido à adsorção espontânea de espécies químicas que modificam
quimicamente a superfície desses eletrodos gerando os eletrodos quimicamente
modificados (EQM). Estes eletrodos são largamente utilizados para evidenciar
diversos íons metálicos em meio aquoso. Para obter uma posterior evidenciação de
metais é necessário o estudo de alguns parâmetros para o ligante, sendo a
dependência do potencial formal pelo pH da solução um importante parâmetro nos
estudos eletroquímicos. O potencial formal é necessário para avaliar o
comportamento eletroquímico de compostos orgânicos (ex: alizarina) que são
ligantes em potencial, pois é através do potencial formal que se conhece o
envolvimento de prótons e elétrons nos processos eletroquímicos estudados
(MARQUES et al., 1995). Nesse contexto, o presente estudo teve como objetivo
verificar a influência do pH e potencial formal do EGP-edge modificado com o
ligante alizarina.
MATERIAL E MÉTODOS: Os experimentos de voltametria cíclica foram realizados no
Potenciostat/Galvanostato Autolab PGSTAT 128N, acoplado a um computador com o
software Nova 1.6 para obtenção dos voltamogramas. Realizou-se esses
experimentos em célula eletroquímica de 50,0 mL, na qual adicionou-se 20 mL de
tampão Britton Robisson (BR). A célula continha entradas para eletrodos de
referência (calomelano saturado), de trabalho (EGP-edge), auxiliar (fio de
platina) e também para o borbulhamento de gás nitrogênio. O plano edge é obtido
com corte do grafite pirolítico de forma perpendicular ao plano basal do mesmo
grafite. Os estudos foram realizados em meio aquoso, onde a modificação da
superfície do EGP-edge com alizarina foi obtida com a imersão do eletrodo na
solução aquosa de alizarina (1x10-3 mol L-1) por um tempo de aproximadamente 40
s, sobre agitação mecânica. Nos experimentos o comportamento eletroquímico do
ligante alizarina adsorvido na superfície do EGP-edge foi estudado nos pHs 2.06;
3.60; 5.10; 6.52; 8,06 e 9,45. Estes foram obtidos com a adição da solução
aquosa de NaOH (1,0 mol L-1) gota a gota na solução do Tampão BR. Para os
processos reversíveis do ligante alizarina o potencial formal foi calculado pela
média aritmética dos potenciais de pico da onda anódica e catódico em cada pH
estudado. Já para o processo irreversível (meio ácido) foi obtido apenas pelo
potencial de pico da onda anódica.
RESULTADOS E DISCUSSÃO: De acordo com a Figura 1, em pH 2,06 a alizarina apresentou dois processos de
oxidação (em -0,187 V e -0,275 V) e uma redução (em -0,294 V), a medida que se
reduz a concentração de íons H+ os dois processos de oxidação vão sofrendo
sobreposição, como pode ser observado no pH 3,60. Neste ainda existem duas
oxidações sem resolução (em -0,338 V e -0,302 V), além de uma redução em - 0,377
V. Verificou-se que o aumento de pH causou um deslocamento de potencial para o
lado negativo (catódico) como era esperado teoricamente para uma espécie química
eletroativa que obedece a equação de Nernst (BARD; FAULKNER, 2001). A partir do
pH 5,10 a alizarina apresentou um processo redox reversível (oxidação em - 0,390
V e redução a - 0,451 V), já no pH 6,52 oxidação a - 0,451 V e redução em -
0,538 V. Nos pHs superiores a 6,52 foi notado uma deformação dos processos
redox, ocasionado pelo aumento da concentração de íons OH-. O gráfico do
potencial formal nos valores de pHs compreendidos entre 2,06 a 9,45 revelou uma
dependência linear, do potencial formal em função do pH da solução, com
R2=0,997. Esse gráfico forneceu um coeficiente angular de -48 mV pH-1
(Fernandes, 1998), sendo esse valor bastante próximo do esperado teoricamente
para uma meia reação envolvendo uma razão unitária de prótons e elétrons (ZHANG;
LEVER; PIETRO, 1995). Esses dados garantem que a redução da alizarina é
representada pela equação química da Figura 2. Portanto, o ligante alizarina
apresenta uma redução reversível com envolvimento de dois prótons e dois
elétrons (MARQUES et al., 1995), sendo o grupo paraquinona o responsável por
esse processo eletroquímico.
Figura 1
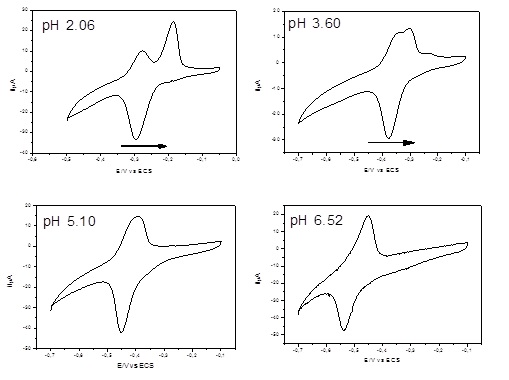
Voltamogramas cíclicos do ligante alizarina
adsorvido no EGP-edge (0,172 cm2) nos
pHs: 2,06; 3,60; 5,10 e 6,52, com v = 50 mV s-1
Figura 2
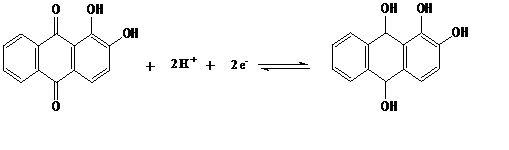
Reação que mostra o processo redox referente à
redução reversível do ligante alizarina
CONCLUSÕES: O pH influência nos processo redox do ligante alizarina, onde a mesma apresenta
dois processos de oxidação e uma redução em pH abaixo de 5. Já em pH superiores a
5, o ligante alizarina exibe um processo redox reversível. Com o aumento de pH o
potencial é deslocado para o lado mais negativo obedecendo a equação de Nernst. O
grupo paraquinona do ligante alizarina é o responsável por seu processo redox,
onde o potencial formal de -48 mV pH-1 garante o envolvimento de dois prótons e
dois elétrons no processo eletroquímico relacionado a redução da alizarina
AGRADECIMENTOS: Ao IFPI, UFPI e ao Grupo BIOTEC
REFERÊNCIAS BIBLIOGRÁFICA: BARD, A. J.; FAULKNER, L. R. Electrochemical methods, fundamentals and applications. John Wiley and Sons; New York, 2001.
FERNANDES, E. N. Estudo comparativo de algumas alizarinas por voltametria e espectrofotometria. 1998. 87 f. Dissertação (Mestrado em Química) – Universidade Federal
do Maranhão, São Luis, 1998.
MARQUES, A. L. B.; ZHANG, J. J.; LEVER, A. B. P.; PIETRO, W. J. Journal of Electroanalytical Chemistry, vol. 392, p.43-53, 1995.
ZHANG, J. J.; LEVER, A. B. P.; PIETRO, W. J. Journal of Electroanalytical Chemistry, vol. 385, n° 2, p.191-200, 1995.
