Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Efeito de matriz na quantificação simultânea de aflatoxina B1 e M1 em leite utilizando CLAE-FL
AUTORES: Scaglioni, P. (FURG) ; Souza, T. (FURG) ; Rodrigues, M.H. (FURG) ; Badiale-furlong, E. (FURG)
RESUMO: Neste trabalho foi estudado o efeito da interferência da matriz durante a
quantificação das aflatoxinas B1 e M1 em leite. Foram construídas curvas no
solvente e na matriz, sendo utilizado um cromatógrafo líquido de alta eficiência
com detector de fluorescência para estimar as equações das curvas. Elas
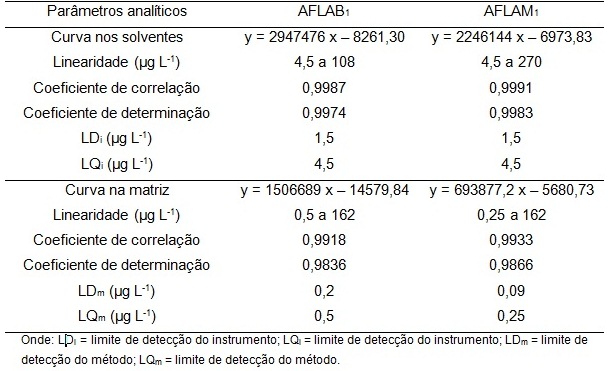
mostraram amplas faixas de linearidade, com LDi, LQi, LDm e LQm iguais a 1,5;
4,5; 0,2 e 0,5 μg L-1 para a AFLAB1 e 1,5; 4,5; 0,09 e 0,25 μg L-1 para a
AFLAM1. O efeito da matriz foi verificado pelos coeficientes lineares das curvas
com solvente e com extrato da amostra, além da relação entre as áreas
resultantes da matriz fortificada e do padrão diluído no solvente. Ficou
demonstrado que as curvas de matriz são necessárias para quantificar as
aflatoxinas B1 e M1 em amostras de leite.
PALAVRAS CHAVES: curva nos solventes; curva na matriz; aflatoxinas
INTRODUÇÃO: Micotoxinas são substâncias tóxicas resultantes do metabolismo secundário de
diversas linhagens de fungos filamentosos. São de ocorrência universal, porém
predominam em climas tropicais e subtropicais (LILLEJOH, 1991). As micotoxinas
de maior importância em alimentos e rações são as aflatoxinas, produtos tóxicos
oriundas de espécies do fungo Aspergillus. Quando o gado leiteiro consome ração
contaminada com AFLAB1 há degradação parcial desta no rumem e o animal pode
intoxicar-se ou excretar a micotoxina metabolizada pelo leite, o metabólito
AFLAM1 (CREPPY, 2002; MOSS, 2002).
Os métodos para a determinação de AFLAM1, em amostras de leite e derivados
utilizam como base a propriedade fluorescente da toxina, quando exposta à luz
ultravioleta. Atualmente, com o emprego dos métodos por cromatografia líquida de
alta eficiência (CLAE), houve um incremento notável no grau de precisão das
análises, porém, com o aumento significativo dos custos (STUBBLEFIELD e VAN
EGMOND, 1989). Um problema associado a estes ensaios é a possibilidade de
resultados sub ou superestimados devido ao efeito de interferência da matriz.
Isto ocorre porque o método de extração pode não ser específico para o analito
de interesse, além de ser possível a interação com algum componente da matriz,
diferente do analito que se procura (ROSI et al., 2007). A interferência da
matriz pode ser determinada pela razão entre a área do padrão preparado no
extrato branco da matriz e a área do padrão preparado em solvente. Se o valor
para esta razão for igual a 100% não há interferência da matriz nas análises
(TEIXEIRA, 2008).
Neste trabalho foi estudado o efeito da interferência da matriz durante a
determinação de aflatoxinas B1 e M1 obtidas do leite, através da construção de
curvas analíticas no solvente e na matriz.
MATERIAL E MÉTODOS: Os extratos das amostras foram secos logo após a extração (AOAC, 2000),
ressuspensos em 1 mL da fase móvel (ácido acético:acetonitrila:metanol 55:10:35)
e determinados em cromatógrafo líquido (coluna Kromasil C18 5μ 250x4,6mm,
injetor com alça de 20 μL). A corrida cromatográfica foi realizada à 35 °C, com
vazão de 1,0 mL min-1 e detector de fluorescência com λexcitação = 360 nm e
λemissão = 450 nm.
Foram construídas as curvas no solvente, utilizando soluções dos padrões das
AFLAB1 e AFLAM1, diluídas na mistura de solventes da fase móvel, em
concentrações crescentes (4,5; 9,0; 18,0; 27,0; 54,0; 81,0; 108,0; 162,0 e 270
μgL-1). Também foram construídas duas curvas na matriz (com o extrato da
amostra), para isso, amostras de leite foram fortificadas em oito níveis de
concentrações crescentes (0,25; 0,5; 4,5; 18,0; 54,0; 81,0; 108,0 e 162,0 μgL-1)
em triplicata, essas passaram pelo mesmo processo de extração e quantificação
que as demais.
Para estimar o limite de detecção do instrumento (LDi) foram feitas injeções dos
padrões das AFLAB1 e AFLAM1 diluídos na fase móvel em concentrações decrescentes
até obtenção da relação 3:1 entre o pico do analito e o ruído da linha de base.
Para o limite de quantificação do instrumento (LQi) buscou-se a relação 10:1.
Para determinação do limite de detecção do método (LDm) e do limite de
quantificação do método (LDm) foram injetados os extratos das amostras
fortificados até que se obtivesse a mesma relação descrita para os limites
instrumentais (RIBANI et al.,2004).
O efeito de matriz foi verificado através da razão entre a área do pico
resultante da injeção da matriz (isenta de contaminação) fortificada com os
padrões das micotoxinas e a área do pico resultante da injeção dos padrões (na
mesma concentração anterior) diluídos no solvente.
RESULTADOS E DISCUSSÃO: Os resultados (Tabela 1) mostraram que o procedimento foi adequado para a
quantificação das duas aflatoxinas, uma vez que seus indicadores cumprem as
recomendações quanto aos critérios de confiabilidade, pois a ANVISA (2003)
recomenda um R2 = 0,99 e o INMETRO (2003) um valor acima de 0,90. As
linearidades das curvas apresentaram ampla faixa de concentração, as curvas na
matriz mostraram o efeito dos interferentes inerentes ao extrato na amostra.
Além disso, a razão entre as áreas resultantes da integração dos picos dos
padrões na matriz e dos padrões nos solventes resultou em uma relação média de
37,8 e 18,2 % para a AFLAB1 e AFLAM1, respectivamente. Sabendo-se que quanto
mais próxima de 100% for essa relação, menor é o efeito da matriz, verificou-se
que ambas micotoxinas sofrem o efeito da matriz leite, de forma inibitória,
reduzindo o sinal cromatográfico significativamente.
Botura (2005) determinou os valores de LD e LQ para um método modificado para a
determinação de AFLAM1 em leite de cabra utilizando CLAE-FL, como sendo iguais a
0,2 e 0,5 μg L-1, respectivamente, enquanto que Oliveira (2010), para validar um
método de quantificação de AFLAM1 em leite de vaca, determinou valores de LDm e
LQm iguais a 0,003 e 0,007 μg L-1, respectivamente.
Os valores de LDm e LQm encontrados no presente estudo apresentaram-se entre os
citados por esses autores e foram considerados satisfatórios, tendo em vista que
o LQm apresentou valor inferior ao legislado para a AFLAM1 em leite no Brasil
(0,5 μg kg-1), enquanto que os LQi apresentaram valores superiores ao limite
legislado, contudo, para utilização na quantificação de amostras fortificadas,
as curvas analíticas no solvente também podem ser aplicadas.
Tabela 1. Parâmetros analíticos avaliados em CLAE-FL.
CONCLUSÕES: A quantificação das aflatoxinas B1 e M1 em leite através de CLAE-FL sofre
influência da matriz de forma inibitória, sendo necessária a utilização de uma
curva específica para cada caso.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ANVISA - Agência Nacional de Vigilância Sanitária, Resolução RE nº 899, de 29/05/2003. . Disponível em: <www.anvisa.gov.br>. Acesso em: 11 dez. 2012.
AOAC - Association of Official Analytical Chemists. Official Methods of analysis international, 17th. 2000. CD-ROM, Willian Horwitz.
BOTURA, M. B. Otimização de métodos analíticos para determinação de aflatoxinas em rações e leite de cabra, e sua ocorrência no estado da Bahia. UFBA, 2005. Dissertação (Mestrado em Medicina Veterinária Tropical) – Escola de Medicina Veterinária da Universidade Federal da Bahia.
CREPPY, E. E. Update of survery, regulation and toxic effects of mycotoxins in Europe. 2002. Toxicology Letters, 127: 19-28.
INMETRO - Instituto Nacional de Metrologia, Normalização e Qualidade Industrial, Orientações sobre Validação de Métodos de Ensaios Químicos. 2003. DOQ-CGCRE-008.
LILLEJOH, E. B. Aflatoxins: an ecologically elicited genetic activation signal. In: SMITH, J. E.; HENDERSON, S. Mycotoxins and Animal Foods. 1991. Boca Ratón: Eds. CRC Press.
MOSS, M. O. Mycotoxin rewiew: Aspergillus and Penicillium. 2002. Mycologist, 16: 116-119.
OLIVEIRA, M. S. Validação de metodologia analítica para análise de aflatoxina M1 e sua ocorrência em leite bovino comercializado no sul do Brasil. UFSM, 2010. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos), Universidade Federal de Santa Maria.
OPS - Organización Panamericana de la Salud. Micotoxinas - Critérios de Salud Ambiental. 1983. Washington.
RIBANI, M.; BOTTOLI, C. B. G.; COLLINS, C. H.; JARDIM, C. S. F.; MELO, L. F. C. Validação em métodos cromatográficos e eletroforéticos. 2004. Química Nova, 27: 771-780.
ROSI, P.; BORSARI, A.; LASI, G.; LDI, S.; GALANTI, A.; FAVA, A.; GIROTTI, S.; FERRI, E. Aflatoxin M1 in milk: Reliability of the immunoenzymatic assay. 2007. International Dairy Journal, 17: 429-435.
STUBBLEFIELD, R. D.; VAN-EGMOND, H. P. Chromotographic methods of analysis for aflatoxin M1. In: VAN-EGMOND, H. P. (ed.) Mycotoxins in dairy products. 1989. London: Elsevier Applied Science.
TEXEIRA, S. A. Adequação e apresentação de parâmetros de validação intralaboratorial de um ensaio para a quantificação de Aflatoxinas em Castanha-do-Brasil (Bertholletia excelsa Bonpl.) através de Cromatografia Líquida de Alta Eficiência. UFRRJ, 2008. Dissertação (Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos) Universidade Federal Rural do Rio de Janeiro.
