Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Síntese, caracterização e estudo do comportamento térmico dos mandelatos de metais alcalinos no estado sólido.
AUTORES: Silva, R.C. (UNESP) ; Caires, F.J. (UNESP) ; Gomes, D.C. (UNESP) ; Gigante, A.C. (UNESP) ; Nascimento, A.L.C. (UNESP) ; Lima, L.S. (UNESP) ; Ionashiro, M. (UNESP)
RESUMO: Os mandelatos de metais alcalinos M(C8H7O3) (M= Na, K, Rb e Cs) foram
sintetizados, caracterizados e a estabilidade e decomposição térmica foram
averiguadas com o auxílio da termogravimetria e análise térmica diferencial
simultânea (TG-DTA), espectroscopia na região do infravermelho (FTIR), absorção
atômica e análise elementar. Os resultados forneceram informações sobre a
composição, desidratação, estabilidade térmica destes compostos em atmosfera
dinâmica de ar.
PALAVRAS CHAVES: metais alcalinos ; mandelato; comportamento térmico
INTRODUÇÃO: O ácido mandélico (HMand) é um alfa-hidroxi-ácido aromático derivado do ácido
glicólico [1,2], com fórmula C8H8O3. A presença de pares de elétrons livres,
provenientes dos grupos hidroxila favorece a reação de complexação com metais.
HMand tem muitas aplicações na indústria de cosméticos, sendo de especial
interesse no tratamento de defeitos da pele tais como acne ou hiperpigmentação.
Devido possuir ação bacteriostática é usado como medicamento para o tratamento
de de infecções do trato urinário, por ser bem excretado pela urina [3].
Não há nada descrito na literatura sobre estudos térmicos sais de metais
alcalinos e alcalinos terrosos com HMand. Fazendo uma busca sobre a interação
entre o HMand e os metais, bem como a caracterização dos mesmos, foi possível
encontrar estudos sobre complexos entre mandelatos e metais de transição [4,5],
lantanídeos [6], organometálicos [7], alguns metais alcalinos e terrosos [8],
porém nenhum destes apresentaram estudos térmicos. Deste modo, o objetivo deste
trabalho foi o de sintetizar os mandelatos de Na+, K+, Rb+ e Cs+ no estado
sólido, caracterizar e investigar o comportamento térmico desses compostos.
MATERIAL E MÉTODOS: O ácido mandélico com 99% de pureza foi obtido da Sigma e usado como recebido.
Os compostos de Na+, K+, Rb+ e Cs+, no estado sólido, foram preparados
misturando os respectivos carbonatos em ligeiro excesso, mantidos em suspensão
aquosa, em banho maria com ácido mandélico. Os precipitados foram filtrados e
mantidos em estufa de circulação forçada para secarem. Depois de secos foram
armazenados em dessecador.
A determinação dos teores de íons metálicos, da água de hidratação e o
conteúdo de ligante nos compostos foram determinados a partir das curvas TG. O
teor de íons metálicos também foi determinado por absorção atômica. Os espectros
de absorção na região do infravermelho foram obtidos em espectrômetro Nicolet
iS10 FTIR, utilizando acessório ATR com janela de germânio. As curvas TG-DTA
simultâneas foram obtidas em um sistema SDT 2960, da TA Instruments. Sob
atmosfera de ar seco com fluxo de 100 mL min-1, com razão de aquecimento de 10
ºC min-1 a massa de amostra cerca de 7 mg em um suporte de amostra de platina.
RESULTADOS E DISCUSSÃO: Os espectros de absorção na região do infravermelho, Fig. 1, mostram que os
estiramentos νas (COO-), ν (O-H) e ν (C-OH) foram deslocados para menores
frequências em relação ao observado no ácido livre, isto sugere que a
coordenação
do ligante aos centros metálicos ocorreu através do grupo hidroxila e de um
oxigênio do grupo carboxila, sugerindo que o ligante se coordenou aos centros
metálicos de forma bidentado-quelante. A determinação do teor de íons metálicos
e
o conteúdo de ligante nos compostos foram determinados a partir das curvas TG. O
teor de íons metálicos também foi determinado por absorção atômica.
As curvas TG-DTA dos compostos são mostradas na Fig.1(b). As curvas revelam que
os compostos de potássio, rubídio e césio decompõem-se em três etapas, com picos
endotérmicos correspondentes a desidratação, fusão (para o potássio) e picos
exotérmicos correspondentes a decomposição e oxidação da matéria orgânica. O
mandelato de sódio é anidro e se decompõe em duas etapas bem definidas. Todos os
compostos apresentaram carbonatos misturados com material carbonizado, como
resíduo final. Os dados analíticos e termoanalíticos dos compostos sintetizados
são apresentados na Tabela 1.
Tabela 1
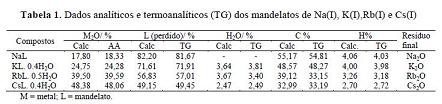
Dados analíticos
Figura 1
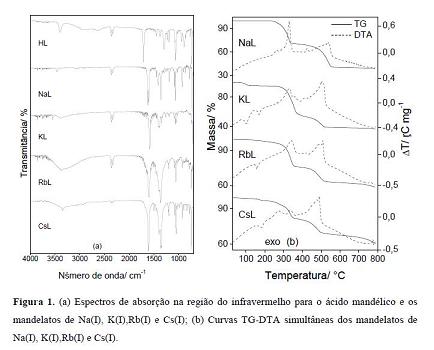
Espectros na região do infravermelho e curvas TG-DTA
dos mandelatos
CONCLUSÕES: Os resultados das curvas TG-DTA forneceram informações sobre a estequiometria
(NaL; KL x 0,4H2O; RbL x 0,5H2O e CsL x 0,4H2O, desidratação, fusão, decomposição
e o teor de metais obtido por absorção atômica foi concordante com o observado
pela curva TG, para o resíduo.
AGRADECIMENTOS: Os autores agradecem a FAPESP, CNPQ e CAPES pelo seu apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1]Kaminsky C A. Alfa-hidroxiácidos. Acta Terap. Dermatol. v. 13, p. 173-177, 1990.
[2]Van Scott E J, Yu R J. Alphahydroxy acids: therapeutic potentials. Can. J. Dermatol. v. 1, p. 108-112, 1989.
[3]Putten P L. Mandelic acid and urinary tract infections. Antonie van Leeuwenhoek, 45(4): 622.doi:10.1007/BF00403669, 1979.
[4]Gomes D J C, Caires F J, Lima L S, Gigante A C, Ionashiro M. Synthesis, characterization and thermal study of solid mandelate of some bivalent transition metal ions in CO2 and N2 atmospheres. J Therm Anal Calorim. DOI 10.1007/s10973-011-2189-y, 2012
[5]Gomes D J C, Caires F J, Lima L S, Gigante A C, Ionashiro M. Thermal behavior of mandelic acid, sodium mandelate and its compounds with some bivalent transition metal íons. Thermochimica Acta.v. 533, p. 16-21, 2012.
[6]Gigante A C, Gomes D J C, Lima L S, Caires F J, Ionashiro M. Synthesis, thermal properties and spectroscopic study of solid mandelate of light trivalent lanthanides. Thermochimica acta.v. 536,p. 6-14, 2012
[7]Terra V. R, Barbiéri R S, Dias A K C, Cardoso M G. Thermal analyses of diorganotin dl-Mandelates. Journal of Thermal Analysis and Calorimetry. v. 67, p. 453-458, 2012.
[8]Schmidt M, Schier A, Schmidbaur H. Magnesium Bis[D(-)-Mandelate] Dihydrate and Other Alkaline Earth, Alkali, and Zinc Salts of Mandelic Acid. Z. Naturforsch. v. 53 b, p. 1098–1102, 1998.
