Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Construção e avaliação de um eletrodo compósito Ag-Ag/AgCl de junção dupla
AUTORES: Cavalcanti, H.C.M. (DEP. QUÍMICA - UFRRJ) ; Sobral, W.S. (DEP. QUÍMICA - UFRRJ) ; Casartelli, E.A. (DEP. QUÍMICA - UFRRJ)
RESUMO: Os métodos potenciométricos de análises baseiam-se na medida do potencial de células eletroquímicas, sem o consumo significante de corrente elétrica. A potenciometria pode ser utilizada de forma direta ou relativa. O presente trabalho apresenta o processo de construção de um eletrodo combinado Ag-Ag/AgCl compósito de junção dupla, e sua aplicação na indicação potenciométrica do ponto final de titulações envolvendo nitrato de prata (método de Mohr). Com um potencial de referência igual a 187 mV. O dispositivo foi avaliado, pela aplicação do teste T emparelhado, comparando-se uma série de titulações com indicação visual com outra usando o eletrodo desenvolvido, havendo concordância em 95% dos resultados.
PALAVRAS CHAVES: potenciometria; eletrodos; compósito
INTRODUÇÃO: Os métodos potenciométricos de análises baseiam-se na medida do potencial de células eletroquímicas, sem o consumo significante de corrente elétrica. A potenciometria pode ser utilizada de forma direta ou relativa. Medidas diretas permitem determinar as concentrações de espécies iônicas diretamente a partir do potencial de eletrodos de membranas seletivas a íons(SKOOG et al., 2005). A potenciometria relativa baseia-se na medida da variação dos potenciais durante uma titulação, pela alteração na atividade da espécie sensível ao eletrodo indicador, resultante de reações, p.ex., de precipitação, complexação ou neutralização. A partir da curva E(mV)XV(mL), determina-se o volume do ponto final da titulação e, então, a concentração da espécie química na amostra. O método mais comumente utilizado para a determinação de cloretos em águas é o método de Mohr, cujo ponto final é detectado visualmente pela formação de Ag2CrO4,de cor vermelha. Os compósitos (RAMÍREZ et al., 2007) apresentam-se como uma alternativa de grande flexibilidade para a produção de eletrodos de estado sólido. Basicamente, são constituídos de uma matriz de resina epóxi contendo os componentes eletroativos em determinada proporção, sendo possível a construção de eletrodos de geometrias adaptáveis a várias configurações de celas potenciométricas, como p.ex. em seringas hipodérmicas(VÁSQUEZ et al., 2002).O presente trabalho objetiva a demonstrar a possibilidade de se construir um eletrodo combinado de Ag-Ag/AgCl compósito, de baixo custo aplicando o dispositivo em titulações do método de Mohr. A viabilidade e a confiabilidade do dispositivo foi avaliada frente à comparação com titulações usando indicador visual, usando o teste t pareado (BAUER, 1971).
MATERIAL E MÉTODOS: Para as medidas potenciométricas foram utilizados os seguintes materiais e equipamentos: potenciômetro PH1900, Instrutherm, resolução de 1mV; agitador magnético Fisatom; pipetas volumétricas, buretas e demais artigos de vidraria. O AgCl foi preparado a partir da reação entre soluções de AgNO3 e HCl, 0,1 mol.L-1; Ag em pó foi preparado através da redução de AgNO3 0,1mol.L-1 com solução de ácido ascórbico 0,1 mol.L-1. O eletrodo compósito de Ag foi preparado, misturando-se Ag em pó a 3 gotas de epóxi (A:B, 3:1) na proporção de 70%. A massa foi inserida diretamente na ponta da seringa, usando a tampa de proteção da agulha (cortada na altura de 5 mm) como molde para o compósito. Um fio de cobre(ø=0,6 mm) inserido na base da ponta da seringa passa pelo seu interior para formar a ligação com o cabo coaxial do potenciômetro. O eletrodo Ag/AgCl foi preparado misturando-se AgCl e Ag em pó na proporção 30:50:20 (epóxi:Ag:AgCl). Um eletrodo de 2 mm de diâmetro interno e 8 mm de comprimento foi produzido em molde plástico. De forma a isolar o eletrólito interno deste eletrodo, usou-se um gel de KCl 3,5 mol.L-1 e carboximetilcelulose a 2%m/v, inserindo o eletrodo em uma mangueira de pvc de 2 cm de comprimento, e após preencher com o gel, a outra extremidade recebeu um plug de filtro de celulose. O interior da seringa foi preenchido com gel de NaNO3 4 mol.L-1 e carboximetilcelulose a 2%m/v. O Eref foi determinado com soluções de Ag+; duas séries de 5 titulações com detecção visual e 5 com detecção potenciométrica utilizando o eletrodo desenvolvido foram comparadas usando o teste T emparelhado para 95% de significância.
RESULTADOS E DISCUSSÃO: O potencial de referência do eletrodo foi igual a 187 mV em relação ao EPH, na temperatura de 25oC. Um eletrodo de Ag/AgCl de junção simples com eletrólito KCl 3,5M exibe um potecial de 205 mV. A Figura 1 apresenta o eletrodo combinado de junção dupla com indicação de seus componentes. A Figura 2 apresenta o perfil das curvas das titulações potenciométricas realizadas. Os volumes médios para as titulações com indicação visual e indicação potenciométrica foram iguais a 9,51 mL e 9,67 mL, respectivamente. O teste t pareado (bicaudal) com 95% de significância e 4 graus de liberdade, resultou em um tcalculado = 0,68, sendo o ttabelado = 2,776. Como o tcalculado é menor, não há diferenças significativas entre os dois conjuntos de titulações.
Figura 1
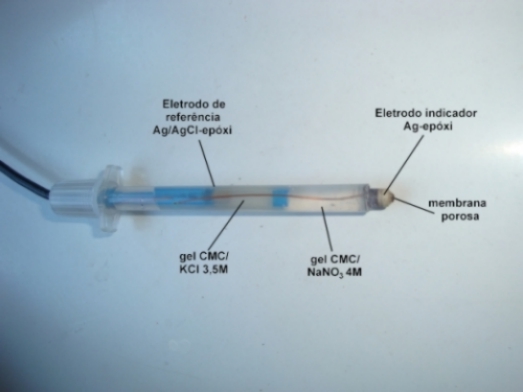
Eletrodo compósito combinado de junção dupla, Ag-Ag/AgCl-epóxi, construído a partir de seringa de insulina de 1 mL. Comprimento de 10 cm.
Figura 2
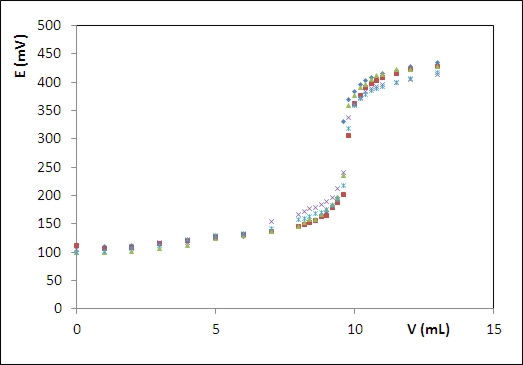
Perfil de sobreposição da série de cinco curvas de titulação usando detecção potenciométrica utilizadas para avaliação do eletrodo desenvolvido
CONCLUSÕES: Conclui-se que o eletrodo compósito na versão junção dupla apresentado, pode ser utilizado na determinação das medidas potenciométricas do método de Mohr, pois os resultados obtidos quando comparados com aqueles da titulação convencional não fornecem resultados diferentes ao se aplicar o teste t emparelhado. O eletrodo é de fácil construção, requerendo materiais facilmente encontrados no comércio. A robustez do dispositivo o torna ideal para uso em aulas experimentais de Análise Instrumental ou de Química Analítica Quantitativa.
AGRADECIMENTOS: Ao Departamento de Química da UFRRJ pelo uso da infraestrutura e reagentes analíticos.
REFERÊNCIAS BIBLIOGRÁFICA: BAUER, E.L.. A statistical manual for chemists, 2nd edition, Academic Press, New York and London, 1973, 193 p.
RAMÍREZ, G.V., ROMERO, G.A.A., VIDAL, C.A.G., RODRIGUEZ, P.R.H., and SILVA, M.T.R., 2005. Composites: A novel alternative to construct solid state Ag/AgCl reference electrodes. Sensors and Actuators B, 110:264-270.
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica, 1ª Edição, Editora Thomson, São Paulo-SP, 2005, 1124 p.
VÁZQUEZ, M.V., and TOBÓN, D.A., 2002. Potenciometría con electrodes de referencia económicos “tipo–jeringa”. Educación Química 13(1): 37-38.
