Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Síntese, caracterização e estudos do comportamento térmico dos glicolatos de La(III), Ce(III) e Pr(III) no estado sólido.
AUTORES: Gomes, D.J.C. (UNESP) ; Gigante, A.C. (UNESP) ; Caires, F.J. (UNESP) ; Nascimento, A.L.C.S. (UNESP) ; Lima, L.S. (UNESP) ; Silva, R.C. (UNESP) ; Ionashiro, M. (UNESP)
RESUMO: Os Glicolatos de La(III), Ce(III) e Pr(III) foram sintetizados, caracterizados e
investigados utilizando-se termogravimetria e calorimetria exploratória
diferencial simultânea (TG-DSC), espectroscopia na região do infravermelho
(FTIR), análise elementar e complexometria com EDTA. Os resultados também
forneceram informações sobre a estequiometria, estabilidade térmica e
comportamento térmico desses compostos.
PALAVRAS CHAVES: lantanídeos trivalentes; glicolatos; comportamento térmico
INTRODUÇÃO: O ácido glicólico faz parte da família dos ácidos alfa-hidroxicarboxílicos
(AHA). Os AHA apresentam um grupo carboxila terminal com um ou dois grupamentos
hidroxila na posição alfa e uma cadeia carbônica de comprimento variável (Clark,
1996). O ácido glicólico apresenta dois carbonos e o ácido láctico, três
carbonos. Este último pode converter-se em sua forma cetônica que é o ácido
pirúvico.
O ácido glicólico (ácido α-hidroxi acético) C2H4O3, tem uma longa história de
seu uso na medicina em relação ao cuidado estético do corpo que está crescendo
rapidamente. Durante a revisão bibliográfica verificou-se que os trabalhos
encontrados referem-se a estudos estruturais dos complexos sólidos de
glicolatos, lactatos e mandelatos de alguns metais de transição bivalentes
(Fischinger, Sarapu e Companion, 1969), espectro na região do infravermelho do
complexo mandelato de Ni(II) (Khadikar et al., 1972), estrutura e propriedades
magnéticas dos mandelatos de metais bivalentes (Beghidja, 2005) e estudos
envolvendo a síntese do glicolato de cério na forma de monocristal (Trombe, Jaud
e Galy, 2005). Poucos estudos utilizando técnicas termoanalíticas foram
encontrados na literatura envolvendo metais de terras raras.
MATERIAL E MÉTODOS: As soluções dos íons metálicos foram preparadas a partir da dissolução dos seus
óxidos (exceto para o cério que se encontrava na forma de nitrato) com ácido
clorídrico concentrado. As soluções foram evaporadas próximas à secura, diluídas
com água destilada e as soluções novamente foram evaporadas próximas à secura
para eliminar o excesso de ácido clorídrico. Em seguida as soluções foram
novamente diluídas com água destilada de maneira a se obter uma concentração da
ordem de 0,15 mol L-1.
Os carbonatos de La(III), Ce(III), Pr(III) foram preparados com adição lenta e
agitação contínua de solução saturada de hidrogeno carbonato de sódio aos
respectivos cloretos (La(III) e Pr(III)) obtidos, enquanto o cério estava na
forma de nitrato, até a precipitação quantitativa dos íons metálicos. Os
precipitados foram lavados com água destilada até a eliminação dos íons cloreto
ou nitrato (teste qualitativo com solução de AgNO3/HNO3 para íons cloreto ou
solução de difenilamina em ácido sulfúrico para íons nitrato) e mantidos em
suspensão aquosa.
Os teores dos íons metálicos e dos ligantes foram obtidos a partir das curvas TG
e também por complexometria com EDTA.
Os espectros de absorção na região do infravermelho foram obtidos em
espectrômetro Nicolet iS10 FTIR, utilizando acessório ATR com janela de
germânio.
As curvas TG-DSC simultâneas foram obtidas utilizando os sistemas TG-DSC 1Stare
da Mettler Toledo, atmosfera dinâmica de ar seco com vazão de 50 mL min-1, massa
de amostra em torno de 10 mg, razão de aquecimento de 10 °C min-1 em um cadinho
de α-alumina.
RESULTADOS E DISCUSSÃO: Os resultados obtidos das curvas TG permitiram estabelecer a estequiometria
desses compostos que estão de acordo com a fórmula geral: Ln(L)3 “Ln” representa
os íons lantanídeos trivalentes, “L” é α-hidroxi-acetato.
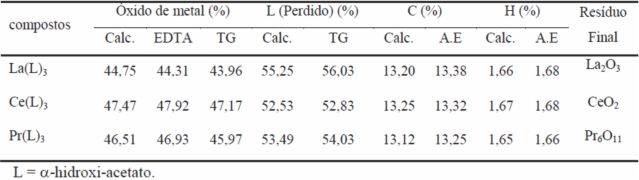
A determinação do teor de íons metálicos e o conteúdo de ligante no compostos
foram determinados a partir das curvas TG. O teor de íons metálicos também foi
determinado por complexometria com EDTA (Ionashiro, Graner e Zuanon Netto,
1983). Conteúdos de carbono e hidrogênio foram determinados por cálculos
baseados nas perdas de massa observadas nas curvas TG, uma vez que a perda de
ligante durante a decomposição térmica ocorre com a formação dos respectivos
óxidos com estequiometria conhecida, como resíduo final. Os dados analíticos e
termoanalíticos dos compostos sintetizados são apresentados na Tabela 1.
Os espectros de absorção na região do infravermelho mostram que os estiramentos
νas (COO-), ν (O-H) e ν (C-OH) estão deslocados para menores frequências em
relação ao observado no ácido livre. isto sugere que a coordenação do ligante
aos centros metálicos ocorre através do grupo hidroxila e de um oxigênio do
grupo carboxila, sugerindo que o ligante se coordena aos centros metálicos de
forma bidentado-quelante.
As curvas TG-DSC simultâneas dos compostos anidros são apresentadas na Fig. 1.
Nos compostos, as curvas TG mostram perdas de massa em uma única (Ce), três (Pr)
e quatro (La) etapas consecutivas e sobrepostas etapas. As perdas de massa
correspondem a picos endotérmicos que são atribuídos a decomposição térmica e a
picos exotérmicos que são atribuídos a oxidação da matéria orgânica e/ou dos
produtos gasosos liberados durante a decomposição térmica e/ou também oxidação
de Ce(III) para Ce(IV).
Figura 1
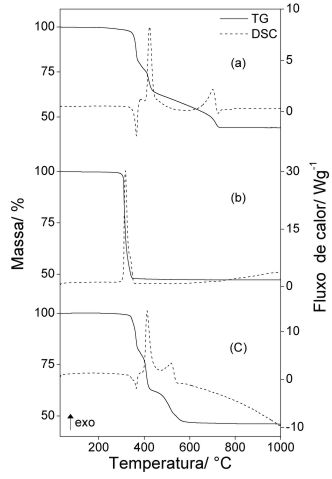
Curvas TG-DSC simultâneas dos compostos. (a) LaL3
(m=10,026 mg), (b) CeL3 (m = 10,070 mg), (c) PrL3
(m = 10,068 mg).
CONCLUSÕES: Os resultados da complexometria e das curvas TG permitiram estabelecer a
estequiometria desses compostos.
Os espectros de absorção na região do infravermelho permitiram sugerir que os
íons metálicos são coordenados pelos grupos hidroxila e carboxilato do glicolato.
As curvas TG-DSC simultâneas permitiram verificar que os compostos foram obtidos
no estado anidro e que a decomposição térmica ocorre em uma, duas e quatro etapas
com perda de massa em intervalos de temperatura característicos de cada composto.
AGRADECIMENTOS: Os autores agradecem a FAPESP, CNPq e CAPES pelo seu apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1]Clark, C. P. Alpha hydroxy acids in skin care. Clinics in Plastic Surgery, v. 23, p. 49-56, 1996.
[2] A. Fischinger, A. Sarapu, A. Companion. Can. J. Chem. v. 47 p. 26-29, 1969.
[3] P. V. Khadikar, S. D. Chanhan, R. L. Kekre, R. L. Ameria. Science and Culture, v. 76
p. 160-399, 1972.
[4] A. Beghidja, S. Hallynck, R. Welter, P. Rabu. Eur. J. Inorg. Chem. v. 4, p. 662, 2005.
[5]J.C. Trombe, J. Jaud, J. Galy. Journal of Solid State Chemistry v. 178 p. 1094-1103, 2005.
[7] IONASHIRO, M.; GRANER, C. A. F.; ZUANON NETTO, J. Titulação complexométrica de lantanídeos e ítrio. Eclética Química, v. 8, p. 29-32, 1983.
