Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: DETERMINAÇÃO DO TEOR DE HISTAMINA EM TILÁPIA PELO MÉTODO ESPECTROFLUORIMÉTRICO
AUTORES: Costa, J.M.B. (UFRN) ; Bezerra, R.M. (UFRN) ; Moura, M.F.V. (UFRN) ; Nascimento, J.M.C. (UFRN) ; Costa, L.S. (UFRN)
RESUMO: Este trabalho teve como objetivo desenvolver uma metodologia viável para se
determinar a concentração de histamina em peixes conhecidos por tilápia do Nilo.
As amostras utilizadas neste trabalho foram pescadas em viveiros da Escola
Agrícola de Jundiaí. Para o preparo da amostra utilizou-se a técnica de extração
em fase sólida por troca iônica para concentração do analito e para a análise do
teor de histamina utilizou-se a espectrofluorimetria. Na determinação de
Histamina levou-se em consideração o tempo de congelamento de 24 horas, 7 dias e
15 dias de congelamento. Os resultados indicaram que houve um aumento do teor de
histamina na amostra com o aumento do tempo de congelamento. A ingestão desta
substancia pode causar problemas de intoxicação alimentar quando for a grande
quantidade.
PALAVRAS CHAVES: Tilápia do Nilo; espectrofluorimetria; histamina
INTRODUÇÃO: O peixe constituí uma importante fonte de proteína de alta qualidade, vitaminas
A, D e E, e do complexo B. A FAO recomenda um consumo mínimo de produtos
pesqueiros de 12 kg por habitante por ano. A média mundial de consumo de
pescados é de 16 kg por habitante ao ano, entretanto espera-se que esse consumo
alcance uma media de 22,5 kg por habitante ao ano até o ano de 2030. Apesar de
todas estas qualidades o pescado é um alimento muito susceptível a deterioração
e com isto podendo levar a formação de aminas biogênicas, principalmente a
histamina. Dentre as aminas biogênicas, podem ser citadas: histamina,
serotonina, tiramina, feniletilamina, triptamina, putrescina, cadaverina,
agmatina e espermidina. Teores elevados destas substâncias podem causar
intoxicação alimentar. Por este motivo, vários índices de qualidade química já
foram propostos para alimentos baseados nos teores de aminas biogênicas. Nesse
trabalho deteve-se especificamente na histamina, onde se fez a determinação da
concentração da mesma através da espectrofluorimetria após extração em fase
sólida do analito de interesse. Os sintomas de intoxicação por histamina podem
começar no intervalo de uma a duas horas após sua ingestão através do peixe
contaminado, e são similares aos da alergia alimentar, como ardor na boca,
vermelhidão facial, erupção cutânea, transpiração excessiva, náuseas e cefaleia.
Os sintomas normalmente duram algumas horas e raramente põe em risco a vida.
MATERIAL E MÉTODOS: Neste trabalho foram utilizados os materiais a seguir: Instrumentos (agitador
magnético, balança analítica, espectrofluorimetro de fluorescência,
multiprocessador, refrigerador); Reagentes (ácido clorídrico nas concentrações
de 0,1 e 1,0 mol/L; solução de ácido fosfórico; solução de aldeído dicarboxi-o-
ftálico; metanol P. A., solução de hidróxido de sódio nas concentrações de 1,0 e
2,0 mol/L, solução de histamina nas concentrações de 1000; 10; 2; 1,5; 1; 0,5 e
mg/mL e resina de troca iônica. Vidrarias (bastão de vidro, béquer 50 e 100,0
mL, pipeta graduada de 10,0, 5,0 e 1,0 mL, vidro de relógio e bureta com
revestimento de polietileno de 25,0 mL, balão volumétrico de 100 mL, erlenmeyer
de 125 mL, funil e proveta de 100 mL, termômetro, espátula de aço, suporte
universal de metal, recipiente de alumínio de 1000 mL, papel de filtro, bico de
Bunsen, tela de amianto, gás butano e barrinha magnética.
As amostras de tilápia foram pescadas e abatidas na Escola Agrícola de Jundiaí e
transportadas imediatamente para o laboratório e depois descamadas e retiradas
as cabeças, espinhas, nadadeira, calda, pele e vísceras. As soluções padrões com
concentrações de 0,05; 0,1; 0,15; 0,2 µg/mL foram levadas ao
espectrofluorímetro. Para a execução do teste de recuperação procedeu-se a todo
o procedimento substituindo à solução da amostra por uma solução padrão a 0,1656
mg L-1. Para extração da histamina procedeu-se ao condicionamento da coluna
fazendo-se passar 5 mL de água destilada. Após o condicionamento fez passar pela
coluna 1,0 mL da solução amostra e mais 35,0 mL de água destilada que foram
recolhidos em proveta de 100,0 mL contendo 5,0 mL de HCl 1,0 mol/L e aferiu-se
para 50,0 mL com água destilada. Esta última solução foi mantida sob
refrigeração até o momento da análise.
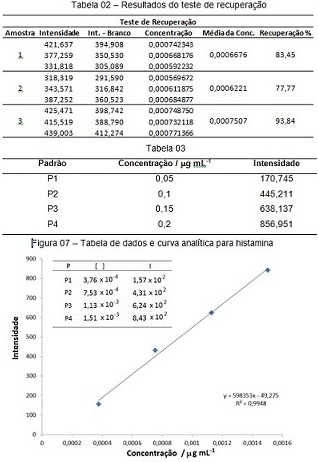
RESULTADOS E DISCUSSÃO: A Tabela 02 apresenta os resultados do Teste de Recuperação. A partir dos
valores obtidos pode-se afirmar que a recuperação foi razoavelmente eficiente,
com uma média de 85,02 %. O desvio padrão de 6,65 apresentou uma dispersão
grande nos valores indicando a necessidade de se melhorar a eficiência da
extração. A Tabela 03 apresenta os resultados relativos às medidas de
intensidade de fluorescência obtidas para as soluções padrão. A Figura 07
apresenta os dados obtidos e a curva analítica para a série de padrões utilizada
neste trabalho. Para a qual obteve-se após regressão linear dos pontos a equação
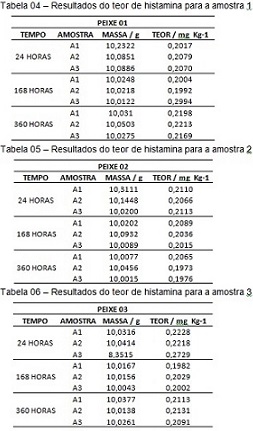
y = 598353x – 49,275. Resultados das análises de histamina nas amostras: As
Tabelas 04, 05 e 06 apresentam os resultados obtidos para análise de histamina
na tilápia obtidas por fluorescência.
Tabela de resultados e curva analítica para histamina
Resultados do teor de histamina para a amostra 1, 2 e 3.
CONCLUSÕES: Foi possível determinar por espectrofluorimetria o teor de histamina em peixes do
tipo tilápia, obtendo-se valores inferiores àqueles exigidos na legislação para
pescado. Foi possível extrair a histamina da matriz biológica (músculo de
tilápia) encontrando-se valores dentro da curva analítica. As perdas foram
repetitivas como indicou os resultados do teste recuperação, obtendo como
resultado para este teste uma média de 85,0 +/- 6,65 %. O estudo da influência do
tempo de congelamento mostrou que para os tempos estudados não se verificou
alteração nos valores de concentração de histamina.
AGRADECIMENTOS: Agradeço, em primeiro lugar, a Deus, a Prof(a) Maria de Fátima Vitória, Prof.
Júlio César, a UFRN, a todos os familiares e amigos. Obrigado a todos.
REFERÊNCIAS BIBLIOGRÁFICA: Instituto Adolfo Lutz, “Métodos Físico Químicos para Análise de Alimentos”, Coordenadores Odair Zenebon, Neus Sadocco Pascuet e Paulo Tiglea, São Paulo, Instituto Adolfo Lutz, 2008.
SOARES, V. F. M.; VALE, S. R.; JUNQUEIRA, R. G.; GLÓRIA, M. B. A.; “Teores de histamina e qualidade físico-química e sensorial de filé de peixe congelado”; Ciência e Tecnologia de Alimentos, Vol. 18, n. 4; 1998.
ASHIE, I.N.A.; SMITH, J.P.; SIMPSON, B.K. Spoilage and shelf-life extension of fresh fish and shellfish. Critical Reviews in Food Science and Nutrition, Boca Raton, v. 36, n. 182, p. 87 – 121, 1996.
BARDÓCZ, S. Polyamines in food and treir consequences for food quality and human health. Trends of Food Science and Technology, v. 6, p. 341 – 346, 1995.
BARDÓCZ, S.; GRANT, G.; BROWN, D.S.; RALPH, A.; PUSZTAI, A. Polyamines in food: implications for growth and health. Journal of Nutritional Biochemistry, v. 4, p. 66 – 71, 1993.
BAUZA, T.; BLAISE, A.; TEISSEDRE, P.L.; CABANIS, J.C. Les amines biogènes du vin, Métabolisme et toxicité. Bulletin L’O.I.V., p. 43 – 67, 1995.
BAYLISS, P. Chemistry in the kitchen: fish and fish products. Nutrition and Food Science, Bradford, n. 1, p.41- 43, 1996.
BELINSKY, D.L.; KUHNLEIN, H.V.; YEBOAH, F.; PENN, A.F.; CHAN, H.M. Composition of fish consumed by the James By Cree. Journal of Food Composition and Analysis, Orlando, v. 9, n.2, p. 148 – 162, 1996.
BRINK, B.; DAMINK, C.; JOOSTEN, H.M.; HUIS IN’T VELD, J.H.J. Occurrence and formation of biologically active amines in foods. Internatiional Journal of Food Microbiology. v.11, p. 73 -84, 1990.
CE (Conformite Europeene). Directiva de 22 de julio de 1991 por la que se fijan las normas aplicabes a la producción y puesta em el Mercado de los productos pesqueros (91/439/EEC). Diario Oficial de la Comunidades Europeas, v. 286, p.15 – 34, 1991.
CINQUINA, A.L.; CALI, A.; LONGO, F.; DE SANTIS, L.; SEVERONI, A.; ABBALE, F. Determination of biiogenic amines in fish tissues by ion-exchange chromatography with conductivity detection. Journal of Chromatography A, v. 1032, p. 73 – 77, 2004a.
CIQUINA, A.L.; CALI, A..; LONGO, F.; DE SANTIS, L.; BACCELLIERE, R.; COZZANI, R. Validation and comparison of analytical methods for the determination of histamine in tuna fish samples. Journal of Chromatography A, v. 1032, p. 79 – 85, 2004b.
COLLINS C.H.; BRAGA G.L.; BONATO P.S., Fundamentos de Cromatografia. Ed. Unicamp. Campinas - SP. cap. V., p. 103 – 104.
FAO (food and Drug Administration) Disponivel em http://www.fao.org. Acesso em 21/04/08.
GLÓRIA, M.B.A. Biogctive amines. In H. Hui, L.L. Nollet. Handbook of Food Science, Tecnology and Engineering. New York: Marcel Dekker, v. 1, p. 1 - 38, 2005.
GLÓRIA, M.B.A.; DAESCHEL, M.A.; CRAVEN, C.; HILDERBRAND Jr. Histamine and other biiogenic amines in albacore tuna. Journal of Aqueatic Food Products and Technology, v. 8, n. 4, p. 55 -69, 1999.
GOODMAN,L.S.; GILMEN, A. Asbases farmacologicas da terapeutica. 10 ed. Rio de Janeiro: McGraw-Hill, 2003. 1647 p.
HALÁSZ, A.; BARÁTH, A.; SIMON-SARKADI, L.; HOLZAPFEL, W. Biogenic amines and their production by microorganisms in food. Trends in Food Science and Technology, v. 5, p. 42 – 49, 1994.
LANARA ( Laboratório Naciona de Referência Animal). Métodos Analiticos Oficiais para Controle de Produtos de Origem Animal e seus ingredientes. Brasilia: Ministerio da Agricultura, 1981, v. 2, cap. 11. Pescado Fresco.
LANGE, J.; THOMAS, K.; WITTMAN, C. Comparison of a capillary eletrophoresis method with high-performance liquid chromatography for the determination of biogenic amines in various food samples. Journal of Chromatography B., v. 779, p. 229 – 239, 2002.
LIMA, A.S.; GLÓRIA, M.B.A. Aminas bioativas em alimentos. Boletim da Sociedade Brasileira de Ciencia e Tecnologia de Alimentos, Cmpinas, v. 33, p. 70 – 79, 1999.
MAIJALA, R.; EEROLA, S.H.; AHO, M.A.; HIRN, J.A. The effect of GDL-induced pH decrease on the formation of biogenic amine in meat. Journal of Food Protection, v. 56, p. 125 – 129, 1993.
MÉNDEZ, E.; GONZÁLEZ, R.M.; INOCENTE, G. Lipid content and fatty acid composition of fillets of six fishes from the Rio de La Plata. Journal of Food composition and Analysis, Orlando, v. 9, n. 2, p. 163 -170, 1996.
MIETZ, J.L.; KARMAS, E. Chemical quality index of canned tuna as determined by high-pressure liquid chromatography. Journal of Food Science, v. 42, p. 155 -158, 1977.
MIETZ, J.L.; KARMAS, E. Polyamine and histamine content of rockfish, salmen, lobster, and shrimp as na indicator of decompodition. Journal of the Association of Official Analytical Chemists, v.61, n.1, p. 139 -145, 1978.
NOGUEIRA, J.A., 2003, Aspectos da biologia reprodutiva e padrões de crescimento da tilapia Oreochromis niloticus, Linnaeus, 1758, (Linhagem Chitralada) em cultivos experimentais. Recife, PE.
NUNES, A.M.N. Qualidade dos pescados – parte II. Higiene Alimentar, São Paulo, v. 8, n. 32, p. 5 – 9, 1994.
OSMAR D.P.; MICHELE A.P.; DIANA I.S.K.; RENATO Z. Departamento de Química, Universidade Federal da Santa Maria, 97105-900 Santa Maria – RS, Brasil.
SASSAKI, L.A., RIBEIRO, P. Intoxicação histaminica por pescado. Higiene Alimentar, São Paulo, v. 5, n. 18, p. 20 – 23, 1991.
SÃO PAULO. Codigo sanitário. Pescado NTA 9. Decreto nº 12486 de 20 de outubro de 1978. São Paulo: Imprensa Oficial de Estado, p. 169 – 170. 1978.
SILLA-SANTOS, M.H. Biogenic amines: their importance in foods. International journal of Food Microbiology, v. 29, p. 675 – 690, 1996.
SILVA, C.M.G., GLÓRIA, M.B.A. Bioactive amines in chicken breast and thigh after siaughter and during storage at 4 ± 1ºC and in chicken-based meat products. Food Chemistry, v. 78, p. 241 – 248, 2002.
SILVA, T.M. Otimizaçao e validação de metodo para determinação de histamina em pescado. Belo Horizonte: Faculdade de Farmácia, UFMG. 2008. 103 P.(Dissertação , mestrado em Ciência de Alimentos).
SILVERSTEIN, R. M.; BASSLER, G. C.; MORRILL, T. C., Identificação espectrométrica de compostos orgânicos 5ª ed., LTC.
SIMONE B.R.; NEIDI G.P.; LUISA H.R.H., Departamento de Tecnologia e Ciência dos Alimentos, Universidade Federal de Santa Maria, 97105-900 Santa Maria – RS, Brasil
SMITH, T.A. Amines im food. Food Chemistry, v. 6, p. 169 – 200, 1980 – 81.
STRATTON, J.E.; HUTKINS, R.W.; TAYLOR, S.L. Biogenic amines in cheese and other fermented foods: a review. Journal of Food Protection, v. 54, p. 460 – 470, 1991.
TAYLOR, S.L. Histamine food poisoning: toxicology end clinical aspects. Critical Reviews in Toxicology, v. 17, p. 91 – 128, 1986.
VECIANA-NOGUÉS, M.T.; HERNANDEZ-JOVER, T.; MARINÉ-FONT, A.; VIDAL CAROU, M.C. Liquid chromatographic method for determination of biogenic amines in fish and fish products. Journal of the Association of Official and Analytical Chemists International, Arlington, v. 78, p. 1045 – 1050, 1995.
VECIANA-NOGUÉS, M.T.; MARINÉ-FONT, A.; VIDAL CAROU, M.C. Biogenic amines as hygienic quality indicators of tuna. Relationship with microbial counts, ATP-related compounds, volatile amines and organoleptc changes. Journal of Agricultural and Food Chemestry, v. 45, p. 2016 – 2041, 1997.
VINADÉ, MARIA ELISABETH do CANTO; VINADÉ, ELSA REGINA do CANTO, Métodos espectroscópicos de analise quantitativa, editora UFSM.
