Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Ambiental
TÍTULO: ESTUDO DE DOCAGEM MOLECULAR DA ENZIMA ACETILCOLINESTERASE (AChE): UM BIOMARCADOR NA CONTAMINAÇÃO POR METILMERCÚRIO
AUTORES: Bentes, B.A. (UNIVERSIDADE FEDERAL DO PARÁ) ; Meneses, C.C.F. (UNIVERSIDADE FEDERAL DO PARÁ) ; Silva, J.R.A. (UNIVERSIDADE FEDERAL DO PARÁ) ; Alves, C.N. (UNIVERSIDADE FEDERAL DO PARÁ) ; Lameira, J. (UNIVERSIDADE FEDERAL DO PARÁ)
RESUMO: A contaminação por mercúrio gera alarde ambiental, pela capacidade de
bioacumulação e biomagnificação, sendo sua forma orgânica, metil mercúrio (MeHg)
mais tóxica. Neste sentido, a enzima Acetilcolinesterase (AChE), é estudada como
biomarcador ambiental. A estrutura 3D da AChE obtida do PDB (2ACE) é usada na
docagem do MeHg como potencial inibidor. Previamente, o substrato natural da
AChE, acetilcolina (ACh) foi realizado para validar o procedimento. Nos
complexos AChE-ACh e AChE-MeHg, obtidos da docagem molecular, observa-se energia
de -77.95 e -19.68 kcal.mol-1, respectivamente, devido a desproporção de volume
molecular. Assim, este estudo contribui para elucidar o modo de acomodação do
MeHg no sítio catalítico da AChE e avaliar esta enzima como biomarcador na
contaminação por mercúrio.
PALAVRAS CHAVES: Acetilcolinasterase; Metil Mercúrio; Biomarcador
INTRODUÇÃO: A dosagem da enzima acetilcolinesterase (AChE), vem sendo empregada como
biomarcador bioquímico para exposição a compostos persistentes no meio ambiente.
A AChE é uma enzima responsável pela hidrólise da acetilcolina (ACh), um éster
neurotransmissor (VIANA, 2005). Este processo evita a propagação contínua do
impulso nervoso, que pode acarretar efeitos comportamentais como hiperatividade,
asfixia e morte.
A AChE é sensível a exposição a organofosforados e carbamatos, sendo a dosagem
da sua atividade frequentemente utilizada como biomarcador de efeito para a
verificação dos efeitos primários da contaminação em diverso organismos,
incluindo peixes, e na avaliação da qualidade das águas. (VIANA, 2005).
Nas últimas décadas tem sido relatada a inibição das colinesterases em várias
espécies por outros contaminantes ambientais que não organofosforados e
carbamatos (COLOMBI, 2009). Em exposições relacionadas ao metil mercúrio (MeHg),
o principal órgão alvo é o sistema nervoso central em todas as espécies. O
primeiro passo na formação do complexo AChE-ACh parece ser o estabelecimento de
uma ligação eletrostática entre a carga positiva do nitrogênio quaternário da
colina do acetil e o sitio aniônico da AChE (COLOMBI, 2009). Por tanto, a
acomodação do metil mercúrio no sítio ativo desta enzima, não permitirá à ACh
ligar-se de maneira adequada a esta enzima, logo não sendo degradada.
Assim, neste trabalho utilizou-se a metodologia de docagem molecular com auxílio
do Molegro Virtual Docker (MVD) versão 2.4, para determinar a região de
acomodação do inibidor metil mercúrio no sítio ativo da enzima AChE. Ampliando o
conhecimento desse inibidor com a enzima-alvo, possibilita avaliar a eficácia da
AChE como biomarcador bioquímico na contaminação por metil mercúrio.
MATERIAL E MÉTODOS: Inicialmente, a estrutura 3D da Acetilcolinasterase (AChE) juntamente com o
substrato Acetilcolina foram obtidos do PDB com o código 2ACE (RAVES, 1997). O
metil mercúrio (MeHg) foi desenhado com o programa HyperChem versão 7.5 (HYPER,
2000.) e submetido à otimização de geometria utilizando o programa Gaussian 03
(FRISCH et al, 2003), a partir do método Hartree-Fock com o conjunto de base
CEP-4G. Os cálculos de docagem molecular foram efetuados utilizando o programa
Molegro Virtual Docker (MVD) versão 2.4 (THOMSEN, 2006). Para a visualização e
análise dos resultados fez-se uso do programa Visual Molecular Dynamics (VMD)
versão 1.9. Os resultados obtidos do complexo AChE-MeHg foram comparados com os
resultados do complexo cristalográfico (AChE-ACh). Finalmente, o mapa de
potencial eletrostático para cada complexo foi calculado com o método APBS
(CALLENBERG, 2010).
RESULTADOS E DISCUSSÃO: A partir deste estudo, obteve-se para o complexo cristalográfico AChE-ACh
energia de -77.95 kcal.mol-1, enquanto para o complexo AChE-MeHg a energia foi
de -19.68 kcal.mol-1. As diferentes energias observadas podem ser justificadas,
principalmente, pela desproporção do volume molecular da ACh e do MeHg, pois o
neurotransmissor (ACh) efetuará mais interações com os resíduos de aminoácidos
da enzima. Porém, o metil mercúrio pode ser considerado um excelente ligante por
complexar-se ao sítio catalítico da AChE de forma semelhante a ACh (Figura 1). A
formação do complexo AChE-ACh, se estabelece por uma ligação eletrostática entre
o nitrogênio quaternário positivo do acetil com o sítio ativo da AChE (COLOMBI,
2009), portanto se o inibidor metil mercúrio ocupar a região de acomodação da
ACh no sítio ativo da AChE, impede que este neurotransmissor ligue-se
adequadamente a enzima, logo não sendo degradado. Na Figura 2A, nota-se que a
posição do metil mercúrio, predita no estudo de docagem molecular, dispõem-se
entre a triagem catalítica formada pelos resíduos de Ser200, His440 e Glu327,
assim como para o neurotransmissor acetilcolina (Figura 2B). No cálculo do RMSD
os respectivos valores para a ACh e o MeHg foram 0,007 e 0,013 Å, o que
representa um baixo desvio entre os dados teóricos e experimentais (NEMUKHIN,
2008; RAVES, 1997).
Figura 1
Acomodação do neurotransmissor acetilcolina (amarelo) e do inibidor metil mercúrio (alaranjado).
Figura 2
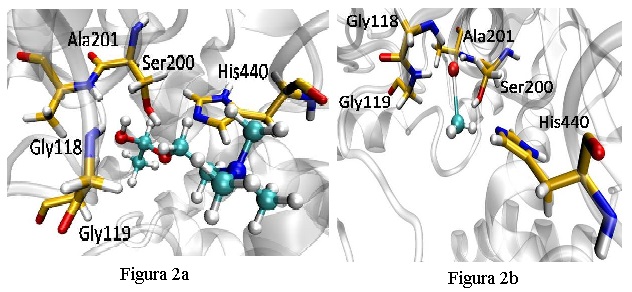
As conformações obtidas para os complexos AChE-Acetilcolina (A) e AChE-MeHg (B).
CONCLUSÕES: Usando técnicas de docagem molecular, obteve-se as interações e os valores de
energia para os complexos AChE-ACh e AChE-MeHg, os resultados mostram-se
satisfatórios em relação ao volume molecular da ACh do MeHg, uma vez que o
neurotransmissor efetuará mais interações com os resíduos de aminoácidos da
enzima. Assim, este estudo contribui para identificar o MeHg como um inibidor da
AChE, que quando acomoda-se no sítio ativo da enzima impossibilita a ligação
adequada da ACh, inibindo as atividades colinesterásicas, tornando esta enzima um
eficiente biomarcador ambiental na contaminação por MeHg.
AGRADECIMENTOS: A Universidade Federal do Pará. A equipe do Laboratório de Planejamento e
Desenvolvimento de Fármacos.
REFERÊNCIAS BIBLIOGRÁFICA: CALLENBERG, K. M.; et al. PLOS ONE, v. 5, p. 1-11, 2010.
COLOMBI, J. S. (2009). Avaliação da acetilcolinesterase como biomarcador em experimentos de contaminação in vitro com MeHg E HgCl2 EM Hoplias malabaricus (BLOCK, 1794).
FRISCH, M. J. et al., GAUSSIAN 03 revision C. 01, GAUSSIAN, INC.: 2003.
HYPER, Inc., ChemPlus: Modular Extensions to HyperChem Release 6.02, Molecular Modeling for Windows, Gainesville,19, 2000.
NEMUKHIN, A.V.; LUSHICHEKINA, S, V.; BOCHENKOVA, A. V.; GOLUBEVA, A. A.; VERFOLOMEEV, S. D. Journal of molecular modeling 2008, 14, 409-416.
RAVES, M. L., HAREL, M., PANG, Y.P., SILMAN, I., KOZIKOWSKI, A. P., SUSSMAN, J. L. Nat Struct Bio, 57-63, 1997.
THOMSEN, R., CHRISTENSEN, M. H. Journal Medical Chemistry, vol. 49, p. 3315-3321, 2006.
VIANA, TAP. 2005. Bioindicadores e mercúrio em tubarões costeiros pescados no estado do Rio de Janeiro, Brasil. [Monografia de bacharelado ] Universidade Federal do Rio de Janeiro – UFRJ, Rio de Janeiro.
