Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Ensino de Química
TÍTULO: MONTAGEM DE PILHAS EM SÉRIE UTILIZANDO DIFERENTES SAIS DE FRUTAS
AUTORES: Ferreira, D.R.M. (UEMA) ; Pereira, M.R.S. (UEMA) ; Menezes, L.C. (UEMA) ; Campos, V.N.S. (UEMA) ; Santos, M.S. (UEMA) ; Silva, R.L.M. (UEMA) ; Vieira, I.R.S. (UEMA) ; Costa, T.T.B. (UEMA) ; Dias, V.R. (UEMA) ; Costa, M.C.P. (UEMA)
RESUMO: Foram montadas pilhas em série de sal de fruta, sendo que as amostras dos sais de frutas foram adquiridas no comércio farmacêutico. Realizaram-se análises de voltagem e pH. Foi efetuada uma comparação entre as voltagens de determinadas pilhas com os valores de pH encontrados, relacionando-os com as composições químicas presentes nos sais.
PALAVRAS CHAVES: Pilha; sal de frutas; voltagem
INTRODUÇÃO: A invenção da pilha elétrica possibilitou significativa evolução científica. Apesar das pilhas representarem atualmente o meio mais popular e barato de produção de energia elétrica para aparelhos portáteis, poucas pessoas associam seu funcionamento à ocorrência de reações químicas (Oliveira et al., 2001). A primeira pilha surgiu pela mão do físico italiano Alessandro Volta, sendo constituída por chapas em forma de moeda em cobre e zinco (os eletrodos), empilhados alternativamente e separadas por discos de feltro, embebidas em solução aquosa de ácido sulfúrico (o eletrólito), ficando conhecida assim como pilha de Volta. O termo pilha é normalmente usado para dispositivos que contenham apenas uma célula voltaica como, por exemplo, as pilhas secas. Consiste em um sistema onde ocorre produção de corrente elétrica de forma espontânea, a partir de dois metais diferentes em um meio ácido ou eletrolítico. Ou seja, ocorre a transformação de energia química em energia elétrica, na qual um metal será oxidado pela perda de elétrons (agente redutor) e o outro será reduzido, ganha elétrons (agente oxidante) (FELTRE, 2009). Neste experimento construiu-se uma pilha em série, onde as fontes conectadas em série têm uma tensão resultante igual à soma das tensões individuais de cada fonte, com o objetivo de verificar a conversão de energia química em energia elétrica, a variação de voltagem e de pH por meio da montagem de pilhas em série de sais de frutas de diferentes marcas.
MATERIAL E MÉTODOS: No experimento foram montadas três tipos de pilha em série com os seguintes componentes: A, A, A; B, B, B; C, C, C. A composição de cada componente consta na Tabela 1. Foram utilizados eletrodos de alumínio e de cobre. Em cada conjunto de três béqueres, foram colocados 100 mL de água destilada em cada béquer e em seguida, três sais de frutas para verificação da voltagem inicial e final por meio do uso de um multímetro e do tempo total de dissolução. A medição de pH foi realizada com auxílio do papel indicador universal e de um pHmetro digital. Repetiu-se o processo para duas marcas diferentes de sais de frutas, e por fim, realizou-se o mesmo procedimento colocando-se em cada um dos béqueres sais de frutas de marcas diferentes (A, B, C), averiguando-se a voltagem inicial e final, o tempo total de dissolução e o pH.
RESULTADOS E DISCUSSÃO: A análise do desempenho das pilhas em série foi realizada tomando como base os componentes dos sais de frutas, de acordo com as embalagens dos produtos, que constam na Tabela 1. Os resultados obtidos das medidas das voltagens inicial e final versus o tempo de dissolução dos sais constam na Figura 1. Em uma primeira comparação entre as pilhas 1, 2 e 3, respectivamente das amostras dos sais de frutas A, B e C, a pilha que apresentou maior voltagem em um menor tempo de dissolução foi a da amostra C, devido ao fato de que em sua composição há a presença de sulfato de magnésio que por ser um agente secante neutro e de ação rápida, dissolveu-se mais rapidamente. Ao fazer-se outro comparativo, incluindo a pilha 4, a qual continha três tipos de sais de frutas diferentes, observou-se que a mesma obteve um desempenho ainda mais relevante devido à mistura realizada com os três tipos de sais de frutas. Assim, com a pilha 4 (A, B e C) alcançou-se uma voltagem maior e um tempo de dissolução menor. Para a medição do pH, utilizou-se o papel indicador universal e para obtenção de dados mais precisos, mediu-se no pHmetro. Na pilha com a amostra A obteve valores de pH 7,0 e 6,5; amostra B pH 6,0 e 6,0; amostra C pH 5,0 e 5,6 e amostra A, B e C 6,0 e 6,2 no papel indicador e pHmetro, respectivamente. Ao relacionar os resultados do papel indicador universal com o pHmetro, observou-se valores semelhantes pois sabe-se que os sais de frutas por conterem sais como o bicarbonato de sódio e o carbonato de sódio em sua composição mantém o pH próximo do intervalo ideal (neutro), ou seja, de 6,0 a 7,0. Por outro lado, a amostra C apresentou pH mais ácido do que as outras, devido conter em sua composição química o ácido cítrico, cuja presença favorece a diminuição do pH e uma ddp maior.
Tabela 1. Esquema de montagem das pilhas e os componentes das amostras

A Tabela 1 apresenta o esquema de montagem das pilhas em série com os respectivos componentes químicos dos sais de frutas para análise.
Figura 1. Voltagens inicial e final versus o tempo de dissolução.
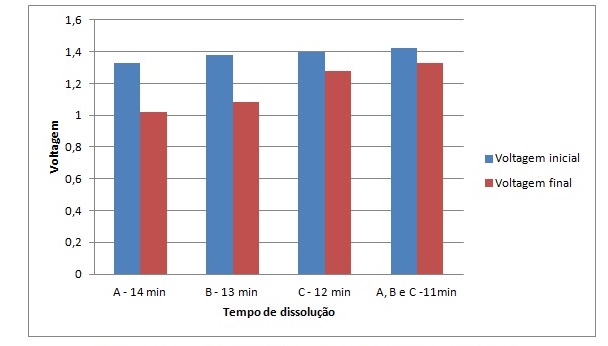
A Figura 1 apresenta as medidas das voltagens inicial e final versus o tempo de total dissolução das amostras dos sais de frutas.
CONCLUSÕES: As pilhas de sais de frutas montadas em série B, C e A, B e C, apresentaram valores de voltagens próximos ao de uma pilha seca (1,5 V), com destaque para a pilha 4 (A, B e C), nas quais foram utilizadas três marcas de sais de frutas diferentes. Isso devido à grande concentração de substâncias diferentes na composição das amostras analisadas. Com relação ao pH das amostras, encontrou-se valores entre 6 e 7. O funcionamento das pilhas, proporciona uma maior compreensão dos processos eletroquímicos, especificamente a conversão de energia química em energia elétrica.
AGRADECIMENTOS: Laboratório de Ensino do Curso de Química Licenciatura da UEMA e Laboratório de Macromoléculas e Produtos Naturais da UEMA.
REFERÊNCIAS BIBLIOGRÁFICA: ATKINS, P. W.; DE PAULA, Julio. Atkins físico-química. 9. ed.. Rio de Janeiro LTC, 2012.
CASTELLAN, G. Fundamentos de físico-química. Rio de Janeiro, Editora LTC, 1986.
FELTRE, R. Química v. II Físico-química, 7ª ed., São Paulo, Moderna, 2009.
GUIMARÃES, C.C. Experimentação no ensino de química: caminhos e descami¬nhos rumo à aprendizagem significativa. Química Nova na Escola, v. 31, n. 3, 2009.
OLIVEIRA, L. A. A.; VALLE, G.G. E ZANLUQUI, L. A. Construção de pilhas elétricas simples – um experimento integrado de química e física. Eclética Química, v.26, 2001.
Pilhas e baterias: funcionamento e impacto ambiental. Química Nova na Escola, n. 11, p. 3-9, 2000. Disponível em: http://qnesc.sbq.org.br/online/qnesc11/v11a01.pdf. Acesso em: 01. Jul. 2013.
Pilhas de Cu/Mg: construídas com materiais de fácil obtenção. Química Nova na Escola, n. 11, Maio 2000. Disponível em: http://qnesc.sbq.org.br/online/qnesc11/v11a09.pdf. Acesso em: 07. Jul. 2013.
http//www.pontociencia.org.br/experimentos. Acesso em: 07. Jul. 2013.
http://www.profpc.com.br/sais.htm. Acesso em: 14. Jul. 2013.
