Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Produtos Naturais
TÍTULO: Avaliação do Conteúdo de Fenóis Totais e Atividades Biológicas de Méis das Abelhas Apis mellifera L. e Melipona subnitida D. (Jandaíra) do Bioma Caatinga
AUTORES: Liberato, M.C.T.C. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Menezes, J.E.S.A. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Alexandrino, C.D. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Silva, M.M.O. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Magalhães, I.L. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Cavalcanti, D.B. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE)
RESUMO: O objetivo deste trabalho foi avaliar o teor de fenóis e das atividades biológicas de méis, produzidos por Apis mellifera e Melipona subnitida no Ceará, e verificar a existência de correlação entre teor de fenóis e atividade antioxidante dos méis das abelhas do Ceará para caracterização desses compostos como alimentos funcionais. As amostras foram obtidas por contato direto com produtores e coletadas em diferentes épocas do ano. O teor de fenóis foi determinado pelo método Folin-Ciocalteau e a atividade antioxidante pelo método do DPPH. Para a atividade antiacetilcolinesterase foi usado o método de Ellman aperfeiçoado por Rhee (2001). Os resultados mostraram correlações lineares entre o teor de fenóis e a atividade antioxidante e o possível uso dos méis como alimentos funcionais.
PALAVRAS CHAVES: Mel; Compostos Fenólicos; Atividades Biológicas
INTRODUÇÃO: O Ceará está no domínio da Caatinga, um bioma semiárido exclusivamente brasileiro, caracterizado por período chuvoso restrito e alta biodiversidade. O mel é o produto das abelhas melíferas a partir do néctar das flores, das secreções de partes vivas das plantas ou de excreções de insetos sugadores que ficam sobre partes vivas das plantas. A maioria das plantas produz néctar, usado pelas abelhas para originar o mel e seus componentes bioativos podem ser transferidos para ele. Assim, a composição e a capacidade antioxidante variam com a fonte floral usada para a coleta de néctar e com fatores externos como clima, ambiente e processamento pelo qual tenha passado. As abelhas podem ser reunidas na superfamília Apoidea, que é constituída por diversas famílias. A de hábitos sociais mais avançados é a família Apidae, que possui quatro subfamílias: Apinae, Meliponinae, Bombinae e Euglossinae. Entre os Apíneos, a única espécie que vive no Brasil é a Apis mellifera. Entre os meliponíneos, destaca-se a abelha Melipona subnitida (Jandaíra), uma abelha nativa sem ferrão, típica do Ceará. O mel de abelha contém metabólitos secundários responsáveis por suas atividades como aldeídos aromáticos, ácidos carboxílicos aromáticos e seus ésteres, derivados de carotenoides, terpenoides, flavonoides e outros. São eles que apresentam propriedades biológicas, destacando-se os compostos fenólicos (Muñoz e Copaja, 2007). O mel da abelha Jandaíra é muito consumido pela população do semiárido cearense sendo considerado de grande importância na medicina tradicional do estado. O objetivo desse trabalho foi comparar o conteúdo de fenóis totais e as atividades biológicas dos méis produzidos pelas duas espécies de abelhas em várias regiões do Ceará.
MATERIAL E MÉTODOS: As amostras foram obtidas de produtores do Ceará. Para a obtenção do total de fenóis, foi usado o método de Folin-Ciocalteau. Diluiu-se 5 g de amostra em 50 mL de água destilada. Após filtração, a 0,5 mL de cada solução foram adicionados 2,5 mL do reagente Folin–Ciocalteau 0,2 N. Após 5 min, foram adicionados 2 mL da solução de Carbonato de Sódio (75 g/L) (Na2CO3). Após 2 horas, a absorbância foi lida a 760 nm, contra um branco de metanol. Ácido Gálico foi usado como padrão. As análises foram feitas em triplicata e a média expressa em mg de Equivalentes de Ácido Gálico (EAG)/100g de mel (Singleton, 1999). A atividade antioxidante dos méis foi determinada pelo método do DPPH. 1,25 mL de uma solução de mel (0,025g/mL) foi adicionada a 1,5 mL de uma solução de DPPH (90 mg/L) em metanol. Após 15 min, a absorbância foi lida a 517 nm contra um branco de água/metanol (1:1). Ácido Ascórbico foi usado como controle positivo. A atividade sequestradora de radical livre foi calculada como % Inibição = [(absorbância do branco – absorbância da amostra)/absorbância do branco] x 100. A média de três leituras de IC50 para cada amostra foi determinada graficamente (Blois, 1958). A determinação da atividade antiacetilcolinesterase baseou-se no método de Ellman adaptado por Rhee et al (2001). As amostras (1,5 a 2,5 mL) foram aplicadas nas cromatoplacas para CCD (DC-Alufolien, Silica gel 60 F254, 0.2 mm Merck). As placas foram borrifadas com as soluções: 5,5'-dithiobis-[2-ácido nitrobenzóico] 1 mM (DTNB ou Reagente de Ellman) e Iodeto de Acetilcolina 1 mM (ACTI), e deixadas em repouso por 3 min. Depois de secas, as placas foram borrifadas com 3 U enzima / mL, e após 10 min a cor amarela apareceu. Onde ocorre inibição da enzima, um halo branco aparece. Fisostigmina foi usado como padrão.
RESULTADOS E DISCUSSÃO: O teor de fenóis totais presentes nos méis da abelha Apis mellifera variou de 13,12 ± 0,89 a 68,55 ± 1,01 mg EAG/100g de mel (Tabela 1), enquanto os valores obtidos para os méis de Jandaíra variaram de 12,26 ± 0,15 a 69,15 ± 0,06 mg EAG/100g de mel (Tabela 2). Os valores obtidos são semelhantes aos resultantes da análise feita por Meda et al (2005) em méis de Burkina Faso (10,21 a 108,5 mg EAG/100 de mel). Os valores da atividade sequestradora de radicais livres (RSA) para méis de Apis mellifera foram de 22,31 ± 0,45 a 94,36 ± 1,42 mg/mL (Tabela 1) e para os de Jandaíra foram 10,79 ± 0,25 a 95,54 ± 0,87 mg/mL (Tabela 2). Baltrušaitytė et al (2007) encontrou valores de 31,1 ± 4,5 a 86,9 ± 0,9 %, para a atividade antioxidante pelo método do DPPH analisando méis da Lituânia. A atividade de inibição da acetilcolinesterase variou de 0,5 a 0,8 para méis de Apis mellifera e de 0,6 a 0,8 para meis de Jandaíra. Foi encontrada uma correlação linear entre fenóis totais e atividade sequestradora de radicais para os méis de Jandaíra (R2= 0,7365) e uma para os méis de Apis mellifera (R2=0,5946) (Figuras 1 e 2).
Tabela 1 – Fenóis Totais, Atividade Antioxidante e Inibição da Acetilc
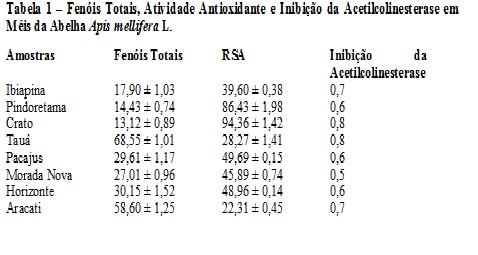
Apresenta os resultados das análises de teor de fenóis totais, atividade antioxidante e atividade antiacetilcolinesterase para méis de Apis mellifera
Tabela 2 – Fenóis Totais, Atividade Antioxidante e Inibição da Acetilc
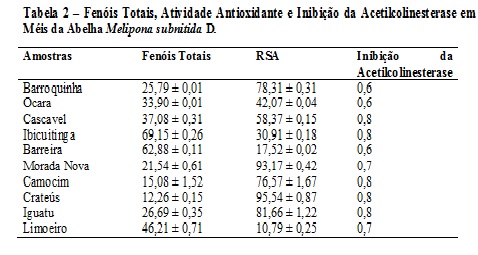
Apresenta os resultados das análises de teor de fenóis totais, atividade antioxidante e atividade antiacetilcolinesterase para méis de Melipona subnitida
CONCLUSÕES: Os teores de fenóis totais e os valores da atividade antioxidante encontram-se de acordo com a literatura. Alguns resultados de inibição da atividade da acetilcolinesterase apresentaram-se próximos ao padrão fisostigmina (0,9 mm). Importante observar as correlações lineares existentes entre os compostos fenólicos e atividade sequestradora dos radicais livres nas amostras estudadas, especialmente nos méis de Jandaíra. Isso abre a perspectiva do uso dos produtos apícolas da Caatinga na indústria alimentícia, na forma de alimentos funcionais. A descoberta de compostos com potencial farmacológico e da atividade antiacetilcolinesterase enriquece o potencial medicinal destes produtos.
AGRADECIMENTOS: Ao CNPq, à FUNCAP, à UECE e aos apicultores e meliponicultores do Ceará
REFERÊNCIAS BIBLIOGRÁFICA: BALTRUŠAITYTĖ, V., VENSKUTONIS, P. R., ČEKSTERYTĖ, V. Radical Scavenging Activity of Different Floral Origin Honey and Beebread Phenolic Extracts. Food Chemistry, v. 101. p. 502-514, 2007.
MEDA, MEDA, A.; LAMIEN, C. E.; ROMITO, M.; MILLOGO, J.; NACOULMA, O. G. Determination of the Total Phenolic, Flavonoid and Proline Contents in Burkina Fasan Honey, as well as their Radical Scavenging activity. Food Chemistry, v. 91, p. 571-577, 2005.
MUÑOZ, O.; COPAJA, S. Contenido de Flavonoides y Compuestos Fenólicos de Mieles Chilenas e Índice Antioxidante. Química Nova, v. 30, n. 4, p. 848-851, 2007.
SINGLETON, V. L.; JOSEPH, A.; ROSSI, J. Colorimetry of total phenolics with phosphomolibdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture, v. 16, p. 144-158, 1965.
BLOIS, M. S. Antioxidant determination by the use of stable free radical. Nature, v. 181, p. 1199-1200, 1958.
RHEE, I. K., MEENT, M., INGKANINAN, K., VERPOORTE, R. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. Journal of Chromatography A, v. 915, p. 217-223, 2001.
