Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Produtos Naturais
TÍTULO: Composição química e toxidade preliminar dos óleos essenciais das folhas e galhos finos de Piper divaricatum Meyer
AUTORES: Figueiredo, P.L.B. (UFPA) ; Silva, V.M.P. (UFPA) ; Andrade, E.H.A. (UFPA) ; Pinheiro, R.O. (UFPA) ; Maia, J.G.S. (UFPA)
RESUMO: Espécies de Piper encontram-se amplamente distribuídas nas regiões tropicais e
sub-tropicais do mundo. A composição química dos óleos essenciais obtidos das
folhas e galhos finos por hidrodestilação de P. divaricatum coletado em Belém,
Pará, foi analisada por CG/EM. Os óleos essenciais das folhas e galhos finos
apresentaram como principais componentes os fenilpropanóides acetado de eugenol
(22,77% e 10%), eugenol (36,2% e 33,73%) e metileugenol (18,49% e 16,43%) e os
sesquiterpenos β-Elemeno (7,14% e 8,79%) e β-Cariofileno (3,41% e 6,68%),
respectivamente, cujo rendimento em mL/100g no óleo das folhas (2,15%) foi maior
que o dos galhos finos (0,88%). As Cl50 dos óleos essenciais das folhas e galhos
finos foram de 10,4 µg/mL e 25,15 µg/mL, respectivamente, ambos consideradas
bioativos.
PALAVRAS CHAVES: Piper divaricatum; óleo essencial; toxidade preliminar
INTRODUÇÃO: A família Piperaceae compreende 12 gêneros e cerca de 1400 espécies,
especialmente com distribuição pan-tropical. O gênero Piper tem aproximadamente
700 espécies, com cerca de 170 no Brasil. (YUNCKER, 1972). As Piperáceas são
representadas por ervas, cipós, arbustos e, raramente árvores. Na região
amazônica espécies de Piper são usadas na medicina popular (BERG, 2010).
Inúmeras espécies de Piper são aromáticas e como conseqüência seus óleos
essenciais tem sido objeto de constantes estudos. Os óleos essenciais destas
plantas são constituídos por uma ampla diversidade de constituintes químicos
como monoterpenos, sesquiterpenos, fenilpropanóides, aldeídos, cetonas e alcoóis
de cadeia longa (ANDRADE et al., 2009). Propriedades antimicrobiana,
antioxidante e antiinflamatória têm sido reportadas para os óleos essenciais de
Piper (OYEDEJI et al., 2005, SACCHETTI et al., 2005, STANDEN e MYERS, 2004).
Piper divaricatum Meyer é um arbusto com até 9,0 m de altura, conhecido
popularmente por pau-de-angola, jaborandi-manso e betre. A raiz é aromática, de
sabor forte, semelhante ao do gengibre; suas folhas e raízes, quando em infusão,
são empregadas internamente contra dores reumáticas e cólicas, e, quando
cozidas,são utilizadas sob a forma de banhos anti-reumáticos GUIMARÃES E
GIORDANO, 2004).
O objetivo deste trabalho foi analisar a composição química dos óleos
essenciaisdas folhas e galhos finos de um espécime de Piper divaricatum e suas
toxidades preliminares frente ao teste com o microcustáceo Artemia salina.
MATERIAL E MÉTODOS: O espécime P. divaricatum foi coletada no campus da Universidade Federal do
Pará, Belém. As amostras (folhas e galhos finos) foram secas separadamente em
estufa com ventilação (35 ºC), moídas e submetidas à hidrodestilação (HD)
utilizando um sistema de vidro do tipo Clevenger mod. acoplado a sistema de
refrigeração para manutenção da água de condensação em torno de 15 oC durante 3h
para extração dos óleos essenciais.
A composição química dos óleos essenciais foi obtida por cromatografia de fase
gasosa/Espectrometria de Massas (CG/EM) em sistema Thermo DSQ-II. A
identificação dos componentes químicos foi baseada no índice de retenção linear
(Índice Kováts) calculado em relação aos tempos de retenção de uma série
homóloga de alcanos e no padrão de fragmentação observados nos espectros de
massas, por comparação destes com amostras autenticas existentes nas bibliotecas
do sistema de dados e da literatura (ADAMS, 2007)
A atividade biológica do óleo essencial foi testada frente às larvas do
microcrustáceo Artemia salina L., cujos ovos foram incubados a temp. amb. (25
°C) em aquário com água salgada artificial. O pH foi ajustado para 9,0 usando-se
Na2CO3 para evitar o risco de morte das larvas por redução do pH durante a
incubação. Após 24 h da eclosão dos ovos, foram preparadas soluções do óleo nas
concentrações de 100, 50, 25, 10, 5 e 1 µg/mL, utilizando-se a água da salmoura
como veículo e sulfóxido de dimetila a 5% como diluente. Em cada tubo contendo
as soluções foram colocadas 10 larvas de A. salina e após 24 h foi calculada a
taxa de mortalidade das larvas, com estimativa da concentração letal média
(CL50), usando o método estatístico Probitos (Finney, 1971).
RESULTADOS E DISCUSSÃO: Os rendimentos dos óleos essenciais das folhas e galhos finos de P. divaricatum
foram de 2,15% e 0,88%, respectivamente. A porcentagem dos constituintes
químicos (≥0,5%) e seus respectivos índices de retenção encontram-se na tabela
01. Os constituintes majoritários dos óleos essenciaisdas folhas e galhos finos
foram os fenilpropanóides: Acetado de eugenol (22,77% e 10%), Eugenol (36,2% e
33,73%) e Metileugenol (18,49% e 16,43%) e os sesquiterpenos β-Elemeno (7,14% e
8,79%) e β-Cariofileno (3,41% e 6,68%), respectivamente. O gráfico 01 mostra a
concentração destes componentes nos óleos essenciais da folhas e galhos finos.
Os óleos essenciais das folhas e galhos finos de P. divaricatum mostraram
atividade larvicida frente às larvas de A. salina, indicando que possui
relevante atividade biológica. De acordo com Meyer e colaboradores (1982),
amostras de óleos e extratos de plantas são considerados tóxicos quando os
valores de CL50 se situam abaixo de 1000 μg mL-1. Os valores da CL50 para os
óleos de P. divaricatum das folhas e galhos finos foram 10,4 µg.mL-1 e 25,15 µg.
mL-1, respectivamente.
Tabela 01:
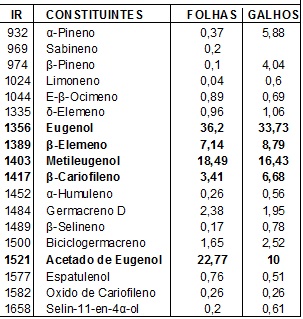
constituintes químicos dos óleos das folhas e
galhos finos de P. divaricatum
Gráfico 01:
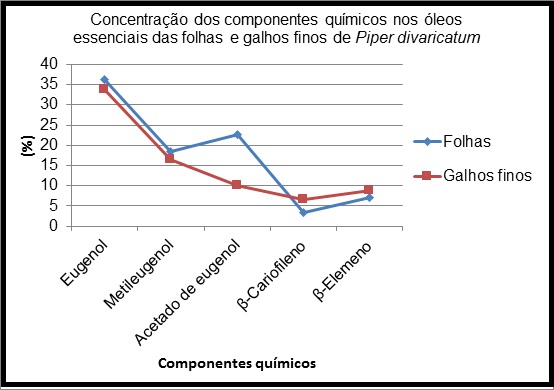
Concentração dos componentes químicos nos óleos
essenciais de Piper divaricatum
CONCLUSÕES: O rendimento de óleo essencial obtido nas folhas de Piper divaricatum foi duas
vezes superior ao dos galhos finos, o que é comum entre as plantas aromáticas. O
perfil cromatográfico da composição química entre os órgãos analisados foi
semelhante, com exceção do acetato de eugenol, cuja concentração nas folhas foi
acima do dobro daquela obtida nos galhos finos. Tanto o óleo essencial das folhas
quanto o dos galhos finos mostraram-se bioativos com relação à toxidade preliminar
frente à Artemia salina.
AGRADECIMENTOS: PIBIC/CNPq e FAPESPA
REFERÊNCIAS BIBLIOGRÁFICA: ADAMS, R.P. Identification of essential oil components by gás chromatography / mass spectrometry.Illinois: AlluredPublishing Corporation, 2007.
ANDRADE, E.H.A.; GUIMARÃES, E.F., MAIA, J.G.S..Variabilidade Química em óleos Essenciais de Espécies de Piper da Amazonia. FEQ/UFPA, Belém, 448p. 2009.
BENITEZ, N. P.; LEÓN, E. M. M.; STASHENKO, E. E. Eugenol and Methyl EugenolChemotypes ofEssential Oil of Species Ocimum gratissimum L. and Ocimum campechianum Mill. from Colombia. Journal of Chromatographic Science. Vol. 47, October 2009.
BERG, M. E. van der. Plantas Medicinais na Amazônia: Contribuição ao seu conhecimento sistemático. 3ª ed., MPEG, Belém, 2010.
FINNEY D.J. Probits analysis. 3rd ed. Cambridge UniversityPress. 1971.
GUIMARÃES, E. F.; GIORDANO, L. C. S. Piperaceae do Nordeste brasileiro I: estado do Ceará. Rodriguésia. 55 (84): 21-46. 2004.
MEYER, B.N., FERRIGNI N.R., PUTNAM J.E., JACOBSEN L.B.,NICHOLS D.E., MC LAUGHLIN J.L. Brine shrimp: a convenientgeneral bioassay for active plant constituents. PlantaMedica. 45: 31–4, 1982.
YUNCKER, T. G. The Piperaceae of Brazil. I. Piper – Group I, II, III, IV. Hoehnea, 2: 19-366. 1972.
OYEDEJI, O. A.; ADENIYI, B. A.; AJAYI, O.; KOING, W. A. Essential oil composition of Piper guineense and its antimicrobial activity. Another chemotype from Nigeria Phytotherapy Researsh, 2005, 19(4), 362-364.
SACCHETTI, G.; MAIETTI, S.; MUZZOLI, M.; SCAGLIANTI, M.; MANFREDINI, S.; RADICE, M.; BRUNI, R. Comparative evaluation of 11 essential oils of different origin as functional antioxidants, antiradicals and antimicrobials in foods. Food Chem. 2005, 91(4), 621-632.
STANDEN, M. D.; MYERS, S. P. The roles of essential oils in the modulation of immune function and inflammation: survey of aromatherapy educators. Inter. J. Aromatherapy, 2004, 14(4), 150-161.
