Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Verde
TÍTULO: Oxidação Catalítica de Glicose de Hidrolisado de Bagaço de Cana-de-açúcar pré-tratado, utilizando Catalisador de Pd/Al2O3 Para Produção de Ácido Glucônico
AUTORES: Soares, I. (UFPE) ; Mendes, K. (UFPE) ; Benachour, M. (UFPE) ; Abreu, C.A. (UFPE)
RESUMO: O ácido glucônico é um dos principais produtos obtidos da oxidação da glicose e
possui muitas aplicações nas indústrias farmacêuticas, metalúrgicas e
alimentícias. Neste trabalho realizaram-se reações de oxidação catalítica da
glicose de hidrolisado enzimático de bagaço de cana-de-açúcar (pré-tratado
previamente com ácido sulfúrico diluído) com ar e catalisador de Pd/Al2O3 em
reator leito de lama trifásico, com o intuito de produzir este ácido. Uma fração
do hidrolisado foi submetida a um processo de purificação com carvão ativado antes
do processo de oxidação, visando precipitar ou retirar impurezas que poderiam
desativar o catalisador. Observou-se um rendimento em ácido de 80% para o
hidrolisado sem tratamento e 90% para o hidrolisado tratado com carvão ativado.
PALAVRAS CHAVES: Bagaço de Cana-de-Açúcar; Hidrolisado Enzimático; Oxidação Catalítica
INTRODUÇÃO: O bagaço de cana-de-açúcar, principal resíduo das indústrias sucroalcooleiras, é
disponibilizado de forma abundante, gerando um impacto ambiental significativo.
Segundo dados do 1° levantamento da safra 2013/2014 feito em abril de 2013 pela
Companhia Nacional de Abastecimento, no Brasil, se prevê que mais de 653 milhões
de toneladas de cana-de-açúcar serão processadas, gerando uma quantidade próxima
a 183 milhões de toneladas de resíduo sólido (CONAB, 2013). No entanto, apenas
uma parte dessa quantidade é utilizada para a produção de energia e o restante é
estocado constituindo um risco devido ao risco de combustão espontânea do
material (LAVARACK et al., 2000; BAUDEL et al., 2005; ROCHA et al., 2011). Esses
resíduos são constituídos principalmente por uma grande quantidade de açúcares e
compostos fenólicos (CARA et al., 2007). Os citados compostos são potencial
fonte para a produção de combustíveis e compostos químicos de alto valor
agregado, tais como ácidos orgânicos e bioetanol(RUDOLF et al., 2008; CARDONA et
al., 2009).Dentre os ácidos orgânicos que podem ser produzidos, destaca-se o
ácido glucônico, obtido através da oxidação da glicose e que apresenta pequenas
toxicidade e ação cáustica, além de fácil biodegradabilidade, podendo formar
complexos solúveis com íons metálicos divalentes e trivalentes em soluções
aquosas (CARVALHO et al., 2005; MIRESCU et al, 2007). Neste trabalho, soluções
de glicose obtidas após hidrólise enzimática de bagaço de cana-de-açúcar pré-
tratado foram submetidas á oxidação catalítica com ar a 50°C, à pressão
atmosférica, na presença de catalisador 2% Pd/Al2O3 para a se obter ácido
glucônico.
MATERIAL E MÉTODOS: O bagaço de cana-de-açúcar usado nos ensaios foi cedido na forma natural pela
Usina Petribú, localizada no Município de Carpina, Estado de Pernambuco e pré-
tratado no DEQ-UFPE. A hidrolise enzimática do bagaço foi realizada da
seguinte forma:uma massa de 52g (na base seca) de bagaço foi hidrolisada pelas
enzimas industriais da Novozymes, com o auxílio da solução tampão ácido
acético/acetato de sódio (pH 4,8) em erlenmeyers de 250 mL por 72h. Após a
hidrólise, o conteúdo dos erlenmeyers foram filtrados, misturados e diluídos em
água destilada para formar um volume de 1L de hidrolisado o qual foi armazenado
em freezer e analisado por Cromatografia Líquida de Alta Eficiência (CLAE) para
determinação do teor de glicose. Posteriormente, 500 mL do litro do hidrolisado
(T ambiente)foram submetidos a uma purificação com adição de carvão ativado
sólido com o intuito de precipitar impurezas que teriam potencial risco de
envenenar o catalisador a ser utilizado na etapa seguinte. O procedimento de
purificação consistiu em dividir os 500 mL do hidrolisado em 10 erlenmeyers
(cada um contendo 50mL) e adicionar em cada um deles uma massa de de 1g de
carvão ativado. Em seguida, os 10 erlenmeyers foram submetidos a uma agitação
durante 60 minutos numa mesa agitadora a 60°C. Os conteúdos dos erlenmeyers
foram filtrados, misturados e armazenados em freezer.Antes da reação de
oxidação, os hidrolisados tiveram seu pH ajustado para um valor próximo de 9 com
o uso de uma solução de NaOH de concentração 2 mol/L. Durante as reações, o pH
do meio reacional foi ajustado de forma manual com o auxílio da solução de NaOH,
cada vez que o valor do pH ficava aquém de 9.Amostras foram retiradas nos
intervalos de tempo:40,80,120,180,220 e 240 min e analisados por cromatografia
líquida
RESULTADOS E DISCUSSÃO: Após a hidrólise enzimática do bagaço pré-tratado e posterior diluição do
hidrolisado obtido, a concentração de glicose no hidrolisado atingiu o valor
máximo de 12,6 g/L. A fração detoxificada após o tratamento com carvão ativado
teve sua concentração de glicose reduzida para 11,7g/L, apresentando um aspecto
visual transparente de mesmo aspecto da solução de glicose pura. Assim, o
tratamento com carvão ativado diminuiu em 8% o teor de glicose, e sendo a
coloração dos hidrolisados devido possivelmente à presença das enzimas, as
características do aspecto visual sugerem que as mesmas foram removidas durante
o tratamento. As Figuras (a) e (b)mostram os perfis de conversão de glicose e os
de rendimento em ácido glucônico, respectivamente.A figura mostra que os perfis
apresentados de conversão de glicose para os dois hidrolisados foram semelhantes
e ambos alcançaram um valor próximo de 70% após 4 horas de reação. Entretanto, o
rendimento em ácido glucônico foi superior no hidrolisado tratado com carvão
ativado, onde foi alcançado um valor máximo próximo a 90% após 4 horas de reação
Isso mostra a importância do processo de purificação do hidrolisado antes do
processo oxidativo, além do potencial de produção de um composto de alto valor
agregado vindo de fontes renováveis. No entanto, observa-se também que as curvas
dos perfis apresentam taxas de variação bastante diferentes em cada intervalo de
tempo. Acredita-se que esse comportamento seja reflexo do controle manual do pH
com a solução de NaOH, o qual seria mais eficiente com o uso de um controlador
automático. Ensaios mais definitivos devem ser feitos para confirmar essa
hipótese.
Figura(a): Conversão da glicose
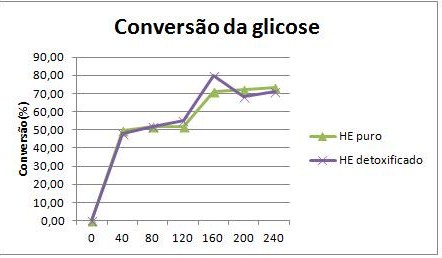
Perfis de conversão da glicose para a oxidação
catalítica do hidrolisado sem tratamento (HE puro) e
tratado com carvão ativado (HE detoxificado).
Figura(b): Rendimento em ácido glucônico
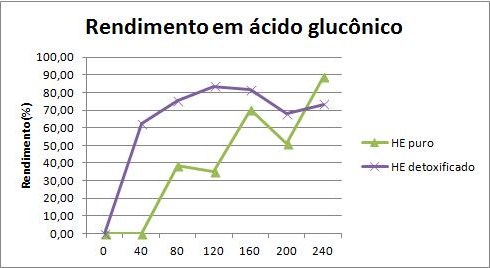
Perfis de rendimento em ácido para a oxidação
catalítica do hidrolisado sem tratamento (HE puro) e
tratado com carvão ativado (HE detoxificado)
CONCLUSÕES: A partir dos resultados obtidos, pode-se estabelecer uma relação qualitativa entre
o processo de purificação dos hidrolisados enzimáticos de bagaço de cana-de-açúcar
com carvão ativado e a eficiência de conversão catalítica da glicose contida
nessas soluções. O carvão ativado não apenas purificou o hidrolisado, deixando-o
com o aspecto de uma solução de glicose pura, mas também removeu pouca matéria-
prima, além de melhorar o rendimento em ácido glucônico. Entretanto, ensaios mais
aprofundados e definitivos devem ser feitos com um controle mais adequado do pH.
AGRADECIMENTOS: Os autores agradecem à CAPES e ao CNPq pelo auxílio financeiro e à Usina Petribú
(Carpina/PE) pelas amostras de bagaço de cana-de-açúcar.
REFERÊNCIAS BIBLIOGRÁFICA: BAUDEL, H.M; ZAROR, C.; ABREU, C.A.M. Improving the value of sugarcane bagasse wastes via integrated chemical production systems: an environmentally friendly approach. Industrial Crops and Products, v.21, p.309–315, 2005.
CARA, C.; MOYA, M.; BALLESTROS, I.; JOSÉ NEGRO, M.; GONZÁLEZ, A.; RUIZ, E. Influence of solid loading on enzymatic hydrolysis of steam exploded or liquid hot water pretreated olive tree biomass. Process Biochemistry,v.42, p.1003-1009, 2007.
CARDONA, C.A., PAZ, J.A.Q.I.C. Production of bioethanol from sugarcane bagasse: status and perspectives. Bioresource Technology,v.101, n.13, p.4754-4766, 2009.
CARVALHO, W.; SILVA, D. D.V.; CANILHA, L.; MANCILHA, I.M. Aditivos alimentares produzidos por via fermentativa. Parte I: Ácidos Orgânicos. Revista Analytica,v.18, p.70-76, 2005.
CONAB. Acompanhamento de safra brasileira: cana-de-açúcar, primeiro levantamento, abril/2013. Brasília, 2013. Disponível em:<http://www.conab.gov.br/OlalaCMS/uploads/arquivos/13_04_09_10_29_31_boletim_cana_portugues_abril_2013_1o_lev.pdf>. Acesso em: 01 jul. 2013.
LAVARACK, B.P.; GRIFFIN, G.J.; RODMAN, D. Measured Kinetics of the acid-Catalysed hydrolysis of sugar cane bagasse to produce Xylose. Catalysis Today, v.63, p.257-265, 2000.
MIRESCU, A.; BERNDT, H.; MARTIN, A.; PRÜβE, U. Long term stability of a 0.45% Au/TiO2 catalyst in the selective oxidation of glucose at optimized reaction conditions. Applied Catalysis A: General, v.317, p.204-209, 2007.
ROCHA, G.J.M; MARTÍN, C.; SOARES, I.B.; SOUTO MAIOR, A.M.; BAUDEL, H.M.; ABREU, C.A.M. Diluted mixed-acid pretreatment of sugarcane bagasse for ethanol production. Biomass and Bionergy, v.35, p.663-670, 2011.
RUDOLF, A.; BAUDEL, H.; ZACCHI, G.; HANN-HAGERDAL, B.; LIDEN, G. Simultaneous saccharification and fermentation of steam-pretreated bagasse using Saccharomyces cerevisiae TMB3400 and Pichia stipitis CBS6054. Biotechnology and Bioengineering, v.99, p.783-790, 2008.
