Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Tecnológica
TÍTULO: Partição de alfa-lactalbumina do soro de leite em sistemas aquosos bifásicos baseados em líquidos iônicos
AUTORES: Sousa, R. (UFV) ; Neves, M. (UFV) ; Domingos, N. (UFV) ; Coimbra, J. (UFV)
RESUMO: Este trabalho teve como objetivo o estudo da partição da proteína α-lactalbumina do soro de leite em sistemas aquosos bifásicos (SABs) constituídos por líquidos iônicos (LI), água e sal inorgânico em função da variação da concentração do LI empregado. Foram preparados por gravimetria SABs formados pelo LI 1-butyl-3-methylimidazolium chloride, pelo sal fosfato de potássio dibásico anidro e água, a 25 ºC com quatro diferentes concentrações do LI (18, 20, 22 e 24%). Após preparados os sistemas e estabelecido o equilíbrio, a concentração da proteína em cada fase foi determinada por espectrofotometria, permitindo o cálculo do coeficiente de partição. Observou-se que a extração da α-lactalbuminano no SAB foi eficiente e que o coeficiente de partição diminui com o aumento da concentração de LI.
PALAVRAS CHAVES: Extração líquido-líquido; Líquido Iônico; Alfa-lactalbumina
INTRODUÇÃO: O soro de leite é o co-produto mais abundante da indústria de laticínios e é rico em proteínas de alto valor nutricional, funcional e tecnológico. Entre essas proteínas, encontramos a α-lactalbumina (α-la) proteína que tem sido reivindicada como um nutracêutico e um aditivo alimentar em fórmulas infantis, devido ao seu elevado conteúdo em triptofano, além de desempenhar função importante na prevenção da úlcera gástrica, causada por etanol absoluto e por estresse (SGARBIERI, 2005). A recuperação e valorização da α-la e outras proteínas do soro é de grande interesse para ambos os campos acadêmico e industrial.
Nesse sentido, surgem novos estudos relacionados à recuperação da α-la. Nos últimos anos, os chamados sistemas aquosos bifásicos (SABs) baseados em líquidos iônicos (LI) têm sido aplicados em processos de biopurificação e bioextração oferecendo diversas vantagens frente aos polímeros usados tipicamente em SAB (JIANG et al., 2009).
Os LI são sais compostos por íons grandes que não formam uma rede cristalina bem definida e, assim, permanecem líquidos à temperatura ambiente ou perto desta. Estes compostos são solventes interessantes, com características "verdes", como a volatilidade desprezível, não-inflamabilidade em condições ambiente, estabilidade térmica e química elevada e grande capacidade de solvatação (HAN e ARMSTRONG, 2007).
O objetivo deste trabalho é estudar o comportamento de partição de α-la do soro de leite em SAB constituídos por líquidos iônicos, água e sal inorgânico em função da variação da concentração de LI empregado.
MATERIAL E MÉTODOS: O líquido iônico utilizado nestes experimentos foi o 1-butyl-3-methylimidazolium chloride ([C4mim][Cl]) e o sal inorgânico, fosfato de potássio dibásico anidro (K2HPO4). A alfa-lactalbumina (α-la) foi adquirida da DAVISCO Food Ingredientes International (Eden Praire, EUA). Além disso, água deionizada foi utilizada para formação dos sistemas.
Os SABs foram preparados de acordo com dados de equilíbrio encontrados em literatura (VENTURA et al., 2011), de modo a se obter sistemas com quatro diferentes concentrações em massa de LI (18%, 20%, 22% e 24%). Em cada sistema eram adicionados sequencialmente, utilizando-se uma balança analítica, 10 mg da proteína, o fosfato de potássio, a água e o líquido iônico. O sistema foi preparado em tubos de centrifuga graduados, de modo que a massa total era 12 gramas. Após a preparação, os SABs foram deixados em repouso por aproximadamente 12 horas, à temperatura de 25 ºC, para que o equilíbrio fosse atingido. Em seguida, com o auxílio de uma seringa, as fases foram separadas, e a determinação da concentração de proteína nas fases foi feita em espectrofotômetro (Cary 50 Probe, Varian, EUA), a 280 nm. Uma curva padrão da proteína nas fases foi previamente preparada, e assim a concentração pôde ser determinada. O coeficiente de partição (razão entre a concentração da proteína na fase superior e inferior) para cada uma das concentrações de LI em estudo foi calculado.
RESULTADOS E DISCUSSÃO: Após a separação das fases, estas foram diluídas em uma proporção de 1:4 com água deionizada, e realizada a leitura da absorbância no espectrofotômetro. A curva padrão da proteína na fase foi feita utilizando-se as mesmas condições. Foi possível determinar a concentração da proteína nas fases superior (Cs) e inferior (Ci) e consequentemente o coeficiente de partição.
Como pode ser observado, a concentração da α-la é muito superior na fase superior (rica no líquido iônico) em relação a fase inferior (rica no sal inorgânico). Isto indica que o LI teve alta capacidade de extração da proteína. Verificou-se também que o coeficiente de partição diminuiu à medida que a concentração do LI aumentou. Com o aumento da concentração do LI adicionada ao sistema, foi observado que o volume da fase superior formada aumentou. Este fato possivelmente acarretou na diminição da concentração da proteína na fase superior, com consequente diminuição do valor do coeficiente de partição.
Tabela 1
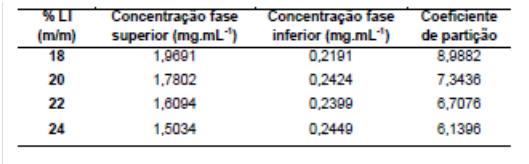
Resultados da extração de alfa-lactalbumina em SABs baseados em LI
CONCLUSÕES: Neste trabalho foi demonstrada a partição de alfa-la do soro de leite em sistema aquoso bifásico constituído por um LI e uma fase aquosa salina. Os resultados obtidos indicam o uso de líquido iônico [C4mim][Cl] como um solvente alternativo para substituir os solventes orgânicos tradicionais em extração líquid-líquido para recuperação de proteína do soro de leite. Este novo sistema de extração é um método promissor para ser empregado na separação e pré concentração da alfa-la.
AGRADECIMENTOS: Os autores agradecem ao CNPq e à FAPEMIG pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: HAN, X. ARMSTRONG, D.W. Ionic liquids in separations, Acc. Chem. Res. 40, 2007, 1079–1086.
JIANG, Y.; XI, H.; YU, J.; GUO, C.; LIU, H. Hydrophobic ionic liquids-assisted polymer recovery during penicillin extraction in aqueous two-phase system. Chemical Engineering Journal 147, 2009, 22–26.
SGARBIERI, V. C. Review: Structural and Physicochemycal properties of milk proteins. Brazilian Journal of Food Technology. v. 8, p. 43-56, 2005.
VENTURA, S. P. M.; SOUSA, S. G.; SERAFIM, L.S.; LIMA, A. S.; FREIRE, M. G.; COUTINHO, J. A. P. Ionic Liquid Based Aqueous Biphasic System with Controlled pH: The Ionic Liquid Cation Effect. J. Chem. Eng. 2011, 56, 4253−4260.
