ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Alves, K.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; da Silva, W.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Taveira, N.S.S. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; de Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
A espectroscopia é uma importante técnica na caracterização de sistemas moleculares. Através do espectro eletrônico molecular baseado nas bandas espectrais pode-se obter inúmeras informações sobre as moléculas.Através da lei de Lambert-Beer e do cálculo da absortividade molar(ε) este trabalho investiga o solvatocromismo das bandas nos complexos inorgânicos [Fe(QC)2] (SO4) e [Zn(QC)2](CH3COO)2, onde QC=quercetina, nos solventes dimetilsulfóxido, álcool metílico e etílico. Observaram-se deslocamentos das bandas de menores energias em função da polaridade do solvente, o que se pode sugerir que estas bandas estão relacionadas às interações metal- quercetina, uma vez que, variação de energia de uma determinada absorção com a mudança de solvente é indicativo de transição de transferência de carga.
Palavras chaves
complexos inorgânicos; quercetina; metais de transição
Introdução
Espectrofotometria na região do UV-Vis do espectro eletromagnético é uma das técnicas analíticas mais empregadas (ROCHA, 2004). Através do espectro molecular pode-se obter inúmeras informações detalhadas da molécula baseando-se nas bandas espectrais (COUTINHO, 1997). Deslocamento nas bandas de absorção da amostra em diferentes solventes é chamado solvatocromismo. Segundo Ribeiro (2003), solvatocromismo é um processo que ocorre em virtude da mudança na posição (algumas vezes na intensidade) de uma banda de absorção, em função de mudanças na polaridade do meio. Do solvatocromismo surge o termo deslocamento solvatocrômico (DS) onde é dividido em hipso e batocrômico. Em geral as teorias procuram retratar o DS em termos dos momentos de dipolo totais e/ou pela polarizabilidade média. Essas quantidades são importantes para descrição da transferência de carga, intramolecular nos estados excitados e intermolecular em complexos (RIBEIRO, 2003). A Quercetina (QC) é um dos flavonoides de extrema importância, sendo encontrada nas frutas, verduras e chás (DUENAS et al, 2012). É extraída das plantas com muita facilidade, possui propriedades farmacológicas, tais como Antiinflamatória, anticarcinogênica, entre outras atividades. A sua coordenação a centros metálicos torna-se bastante atraente, uma vez que, pode potencializar estas atividades. O estudo de solvatocromismo em complexos inorgânicos pode fornecer informações, como confirmações de atribuições nas transições de transferência de carga contidas em complexos inorgânicos. Devido ao princípio de Franck-Condon (LEVER, 1984), o estado excitado do solvente não está em equilíbrio com da molécula. De fato, as transições de transferência de carga apresentadas nos complexos inorgânicos mostram as maiores mudanças no espectro de absorção.
Material e métodos
Utilizando um espectrofotômetro SHIMADZU UV-1800 obteve-se os espectros dos complexos inorgânicos [Fe(QC)2](SO4) e [Zn(QC)2](CH3COO)2 nos solventes dimetilsulfóxido, álcool metílico e álcool etílico em concentrações dos complexos em 1 x 10-3 mol/L, obtendo-se então seis espectros, os experimentos foram realizados utilizando-se uma cubeta de quartzo. A Tabela 01 indica o momento dipolar (µ) dos solventes utilizados em Debye (D) a 25 °C. Utilizando a lei de Lambert-Beer calculou-se a absortividade molar (ε) para cada banda do espectro em cada solução. Para as medidas de absorção da radiação nos comprimentos de onda observados, calculou-se os valores de ε utilizando-se a equação: A= εbc, onde A é a absorvância, c é a concentração da espécie absorvente em mol/L e b, a distância percorrida pelo feixe através da amostra (1 cm).
Resultado e discussão
A Tabela 2 ilustra os valores discutidos para os complexos [Fe(QC)2](SO4) e
[Zn(QC)2](CH3COO)2 nos solventes utilizados.
As bandas em 441, 457 e 440 nm nos espectros do complexo [Zn(QC)2](CH3COO)2
nos solventes dimetilsulfóxido, álcool etílico e metílico, respectivamente,
indicam que houve coordenação do ligante QC ao Zn, os DS nesta banda sugerem
que trata-se de uma interação metal(Zn)-ligante(QC). Observa-se maior
deslocamento batocrômico desta banda quando se utiliza o solvente álcool
etílico, este possui o menor µ.Deslocamentos na direção das energias
menores, o solvente provoca maior estabilização do estado excitado, gerando
uma diminuição na energia de transição. As bandas em maiores energias
observadas nos espectros do complexo [Zn(QC)2](CH3COO)2 são atribuídas às
transições intraligantes π→π* do ligante QC.
As bandas atribuídas à interação metal(Fe)-ligante(QC) no complexo [Fe(QC)2]
(SO4) são 447, 371 e 361 nm nos solventes dimetilsulfóxido, álcool etílico e
metílico, respectivamente.As bandas em 371 e 361 nm encontram-se na mesma
região da transição intraligante π→π* do ligante QC, então estas bandas têm
contribuições tanto da interação Fe-QC como da transição intraligante do
ligante QC. Observam-se maiores deslocamentos hipsocrômicos quando se
utilizam os solventes álcool metílico e álcool etílico, isso é consistente,
pois os dois solventes possuem o µ com valores bem próximos. Isso indica que
o complexo se comporta de acordo com a polaridade do solvente.Quando o
deslocamento ocorre para regiões de energias maiores, o solvente provoca
maior estabilização do estado fundamental, gerando um aumento na energia de
transição.As bandas em maiores energias observadas nos espectros do complexo
[Fe(QC)2](SO4) são atribuídas às transições intraligantes π→π* do ligante
QC.
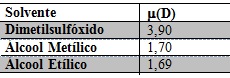
Momento dipolar (µ) dos solventes utilizados em Debye (D) a 25 °C.
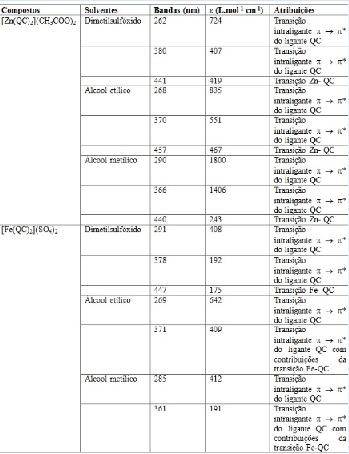
Valores obtidos para estudo do solvatocromismo nos complexos [Fe(QC)2](SO4) e [Zn(QC)2](CH3COO)2 em dimetilsulfóxido, álcool metílico e etílico.
Conclusões
Neste trabalho, estudou-se os efeitos dos solventes dimetilsulfóxido, álcool metílico e álcool etílico nas bandas observadas nos espectros eletrônicos nas regiões do UV-Vis das moléculas de [Fe(QC)2](SO4)2 e [Zn(QC)2](CH3COO)2. Foi observado o surgimento de novas bandas após a síntese dos compostos, indicando que houve coordenação do ligante QC aos centros metálicos em estudo. Com a observação de deslocamentos solvatocrômicos, pode-se sugerir que estas novas bandas são atribuídas às transições Metal-ligante.
Agradecimentos
A PROMAC/UECE pelo auxílio financeiro.
Referências
COUTINHO K. Modelo Discreto de Solvente. Solvatocromismo no Espectro de Absorção Molecular. Tese de doutorado, 1997.
DUENAS, M.; GONZALEZ-MANZANO, S.; SURCO-LAOS, F.; GONZALEZ-PARAMAS, A.; SANTOS-BUELGA, C. Characterization of Sulfated Quercetin and Epicatechin Metabolites. Journal of Agricultural Food Chemistry, no 60, 3592−3598, 2012.
LEVER, A.B.P. Inorganic Eletronic Specroscopy, Elsevier, New York, 1984.
RIBEIRO J. Fotofísica e Determinação de Parâmetros Fotodinâmicos da Ftalocianina de Zinco em Meios Homogêneo e Microheterogêneo. Dissertação de mestrado, 2003.
ROCHA F.R.P; TEIXEIRA L.S.G. Estratégias para Aumento de Sensibilidade em Espectrofotometria UV-VIS. Química Nova, Vol. 27, No. 5, 807-812, 2004.


















