ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Silva Taveira, N.S. (UECE) ; Barbosa da Silva, W.M. (UECE) ; Costa Silva, M.V. (UECE) ; de Oliveira Pinheiro, S. (UECE) ; Maia de Morais, S. (UECE)
Resumo
Quercetina é um flavonoide natural que possui propriedades farmacológicas, tais como Antiinflamatória, anticarcinogênica, entre outras atividades. Grandes concentrações são encontradas em maçãs, cebolas, chá e brócolis.A síntese do composto [Ni(QC)2]Cl2, onde QC=quercetina, se procedeu dissolvendo o sal metálico NiCl2.6H2O em 10 mL de água destilada sob agitação e o ligante QC dissolvendo em 10 mL de metanol, também sob agitação. As duas soluções foram misturadas, formando uma solução amarela, após 20 minutos de reação adicionou-se 3 gotas de trietilamina formando imediatamente uma solução verde. Após 3 horas de reação, a solução foi levada à geladeira, onde se manteve por 2 dias em temperaturas baixas.Observa-se que o o complexo em estudo, obteve resultados positivos para a coordenação.
Palavras chaves
Quercetina; Níquel; Complexos Inorgânicos
Introdução
Os Flavonoides representam um dos grupos fenólicos mais importantes e variados entre os produtos do reino animal, e distribuído com reino vegetal (SIMÕES et al, 2013). Nos últimos anos essas moléculas tem atraído fortemente a atenção de muitos pesquisadores, pois possuem uma ampla variedade de atividades biológicas, físicas e farmacológicas. Elas podem atuar como sequestradores de radicais livres, e como ligantes quelatos para íons metálicos, e essas características são responsáveis por suas propriedades benéficas. A Quercetina (QC) (Figura 01) é um dos flavonoides de extrema importância, sendo encontrada nas frutas, verduras e chás (DUENAS et al, 2012). A interação dos flavonoides com os íons metálicos podem mudar seus efeitos biológicos, sendo a maioria de suas propriedades muitas vezes superiores às dos compostos originais. Figura 01: Representação esquemática da estrutura do flavonoide Quercetina (QC). Os elementos de transição possuem tendência forte para formar composto de coordenação. Esses elementos de transição presentes em complexos podem acelerar a ação de fármacos (SOUSA et al, 2014) A eficiência biológica de complexos metálicos está relacionada à natureza de íons metálicos e os seus ligantes. A ocorrência de sistemas biológicos dependentes de Níquel é muito inferior a de outros metais. No entanto o pequeno número de moléculas contendo Níquel encontrado nos sistemas vivos desempenham muitas funções, tornando o estudo bioinorgânico do Níquel muito importante. Desta forma o presente trabalho descreve a síntese e a caracterização espectroscópica na região do ultravioleta e visível (UV-vis) de um novo complexo metálico obtido através da reação entre o flavonoide natural da Quercetina e o íon metálico Ni2+.
Material e métodos
A síntese foi realizada utilizando-se o sal do metal NiCl2.6H2O e o ligante Quercetina (QC) em uma proporção de 1:2, respectivamente. 30 mg do sal do metal foram dissolvidos e 76,29 mg do ligante QC dissolvidos. O sal do metal foi dissolvido em 10 mL de água destilada e o ligante QC foi dissolvido em 10 mL de metanol. As soluções foram misturadas em um balão de fundo redondo sob agitação e temperatura ambiente, formando uma solução amarela. Após 20 minutos de reação foi adicionado à solução 3 gotas de trietilamina onde imediatamente, a solução que era amarela, ficou verde, a reação ficou sob agitação por 3 horas. Depois desse tempo, a solução foi levada à geladeira por 2 dias e o composto sintetizado então foi precipitado. O rendimento da reação foi de 57%. O espectro eletrônico na região do UV-Vis foi obtido utilizando um espectrofotômetro SHIMADZU UV-1800. Dissolveu-se o composto [Ni(QC)2]Cl2 em solvente metanol, em concentração de 1 x 10-3 mol/L em uma faixa de 200 a 800 nm de comprimento de onda. A fim de comparações, dissolveu-se o ligante QC em metanol em uma concentração de 1 x 10-3 mol/L, também na mesma faixa espectral.
Resultado e discussão
Durante os 20 minutos de síntese do composto [Ni(QC)2]Cl2, a mistura
reacional apresentou uma coloração amarela, após a adição da trietilamina o
composto passou para uma coloração verde e assim se manteve até a obtenção
do composto. Observa-se que praticamente a coordenação da QC ao centro
metálico se deu após a desprotonação dos H ligados aos átomos de oxigênios
dos fenóis na molécula, Figura 01. Após o isolamento do composto verde
relacionado ao complexo inorgânico [Ni(QC)2]Cl2, submeteu-se as análises de
espectroscopia na região do UV-Vis no solvente metanol tanto do ligante QC
quanto do composto em estudo. A Tabela 01 ilustra as bandas relacionadas ao
ligante QC e ao complexo.
Tabela 01 – Dados de Espectroscopia na Região do UV-Vis do ligante QC e do
complexo [Ni(QC)2]Cl2 no solvente metanol.
Composto Bandas (nm)
Quercetina (QC) 378 e 300 nm
[Ni(QC)2]Cl2 460, 388 e 291 nm
O espectro eletrônico da QC em metanol apresenta duas bandas de absorção
relacionadas às transições π π*, uma em 378 nm (= 24.167 mol-1dm3cm-1),
denominada banda I, correspondente ao sistema conjugado entre o anel B e a
carbonila do anel C (sistema cinamoil), e outra em 300 nm ( =24.580 mol-
1dm3cm 1), banda II, referente ao sistema conjugado entre o anel A e a
carbonila do anel C (sistema benzoil). O espectro eletrônico do complexo
[Ni(QC)2]Cl2 em metanol apresentou além dessas duas bandas, o aparecimento
de uma banda em menor energia, 460 nm. O surgimento desta banda sugere a
coordenação do ligante QC ao íon metálico de Ni2+. O deslocamento
batocrômico que ocorre na banda I (de 378 nm na QC para 388 nm no complexo)
pode ser explicado pela interação do Ni2+ com o grupo 3-hidroxil da QC
(Figura 01), resultando em uma redistribuição eletrônica entre a molécula do
flavonoide e o íon metálico, formando um sistema ligante estendido. A
observação da nova banda em 460 nm sugere que o íon Ni2+ esteja ligado ao
grupo fenólico 3-OH e à carbonila 4-oxo do anel C (AHMADI et al, 2011).
Segundo Dehghan (2012), as evidências que suportam esta sugestão estão
relacionadas aos seguintes fatos: o grupo 3-OH é um melhor agente quelante
(o que está relacionado com sua maior acidez frente aos demais) e a
deslocalização dos elétrons do oxigênio do grupo 3-OH é maior, o que
facilita a deslocalização dos elétrons . O grupo 3-hidroxil possui um
próton mais ácido; dessa forma, os grupos 3-OH e 4-oxo são os primeiros
sítios de coordenação envolvidos no processo de comple¬xação e influenciam
no deslocamento da banda. O grupo hidroxila localizado na posição 5 não é
envolvido no processo de coordenação devido a sua menor acidez e ao
impedimento espacial ocasionado pela primeira complexação.
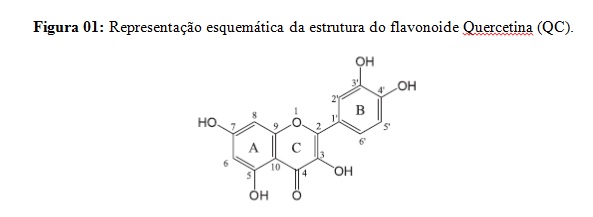
Figura 01: Representação esquemática da estrutura do flavonoide Quercetina (QC).

Tabela 01 – Dados de Espectroscopia na Região do UV-Vis do ligante QC e do complexo [Ni(QC)2]Cl2 no solvente metanol.
Conclusões
Em virtude do crescente interesse na Química de complexo, o presente trabalho estudou a interação entre a QC e o íon Ni²⁺, indicando que houve coordenação do ligante QC ao centro metálico. A síntese de complexos a partir de produtos naturais mostra-se promissora, uma vez que, na literatura já existe alguns compostos de QC com atividades biológicas bem como atividades anti-oxidantes.
Agradecimentos
Referências
SIMÕES, V.N.; FAVARIN, L.R.V.; CABEZA, N.A.; OLIVEIRA, T.D.; FIORUCCI, A.R.; STROPA, J.M.; RODRIGUES, D.C.M.; CAVALHEIRO, A.A.; ANJOS, A. Síntese, Caracterização e Estudo das Propriedades de um Novo Complexo Mononuclear Contendo Quercetina e Íon Ga(III). Química Nova, Vol. 36, No. 4, 495-501, 2013.
DUENAS, M.; GONZALEZ-MANZANO, S.; SURCO-LAOS, F.; GONZALEZ-PARAMAS, A.; SANTOS-BUELGA, C. Characterization of Sulfated Quercetin and Epicatechin Metabolites. Journal of Agricultural Food Chemistry, no 60, 3592−3598, 2012.
SOUSA, E.H.S.; VIEIRA, F.G.M.; BUTLER, J.S.; BASSO, L.A.; SANTIAGO, D.S.; DIÓGENES, I.C.N.; LOPES, L.G.F.; SADLER, P.J. [Fe(CN)5(isoniazid)]3−: An iron isoniazid complex with redox behavior implicated in tuberculosis therapy. Journal of Inorganic Biochemistry, no 140, 236–244, 2014.
AHMADI, S. M.; DEHGHAN, G.; HOSSEINPOURFEIZI, M. A.; EZZATI, N. D. J.; KASHANIAN, S.; Preparation, Characterization, and DNA Binding Studies of Water-Soluble Quercetin–Molybdenum(VI) Complex. DNA Cell Biology, no 30, 517-523, 2011.
DEHGHAN, G.; KHOSHKAM, Z.; Tin(II)–quercetin complex: Synthesis, spectral characterisation and antioxidant activity, Food Chemistry, no 131, 422-426, 2012.


















