ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Ferraz, T.B. (UFPE) ; Lima, N.B. (UFPE)
Resumo
Avaliamos neste trabalho as propriedades termodinâmicas da síntese dos complexos mistos Ln(DBM)3(L,H2O) sendo, Ln= Sm, Eu, Tb ou Gd e L= DBSO, DPSO, PTSO ou TPPO. Verificamos a possibilidade de dissociação de um ligante H2O da estrutura de cada complexo misto, formando assim os complexos Ln(DBM)3(L). No intuito de realizar esse estudo, utilizamos o modelo RM1 orbitais e o programa de química quântica MOPAC 2009. Os nossos resultados mostraram que a formação dos complexos Ln(DBM)3(L,H2O) é mais favorável termodinamicamente quando o ligante não-iônico L é o TPPO. Já a formação do complexo Ln(DBM)3(L) é mais favorável termodinamicamente quando os lantanídeos são Tb ou Gd.
Palavras chaves
Lantanídeos; RM1; Reação de dissociação
Introdução
Complexos de lantanídeos(III) a exemplo do Ln(DBM)3(TPPO)2 são amplamente encontrados na literatura em estudos que ressaltam suas propriedades luminescentes (Lima et al, 2013 e Silva et al, 2013). Entretanto, divergindo da configuração comum de oito interações presentes em complexos Ln(ß- dicetonato)3(L)2, sendo por exemplo os ligantes ß-dicetonatos, TTA, BTFA ou DBM e os ligantes não-iônicos monodentados L, óxidos de fosfina, compostos sulfóxidos, água, etc. Recentemente, foi reportada a síntese do complexo Tb(DBM)3(TPPO), que apresenta apenas sete ligações de coordenação em sua estrutura (Silva et al, 2013). Tendo isto em vista, este trabalho buscou avaliar as propriedades termodinâmicas e fatores que influenciam a síntese dos complexos Ln(DBM)3(L,H2O) e dos complexos Ln(DBM)3(L), nos quais Ln = európio(III), térbio(III), samário(III) ou gadolínio(III) e L = TPPO, PTSO, DPSO ou DBSO (Figura 1). No sentido de avaliar se este caso é uma particularidade dos complexos de térbio(III) com o ligante TPPO, foram analisadas possíveis relações de dependência entre os elementos da série dos lantanídeos e as diferentes espécies de óxidos de fosfina e sulfóxidos com a espontaneidade termodinâmica das reações de formação dos complexos e das etapas de dissociação da água coordenada.
Material e métodos
Na etapa inicial do trabalho todos os complexos de lantanídeos(III) e ligantes livres de coordenação foram esboçados e tiveram suas geometrias pré-ootimizadas no HyperChem. Em seguida realizamos cálculos de otimização completa de geometria de todas as espécies, utilizando para isto o programa MOPAC 2009. Finalmente, calculamos os valores da entalpia de formação e entropia das espécies estudadas com todas as frequências reais (indicativo de que estas estruturas se encontram num ponto de mínimo na curva de energia potencial) para a temperatura de 298 K. De posse desses dados, foram calculadas as energias livre de Gibbs de formação de cada uma dessas moléculas e das reações nas quais estas participam. Todos os resultados foram obtidos com a aplicação do modelo RM1 orbitais (Filho et al, 2013).
Resultado e discussão
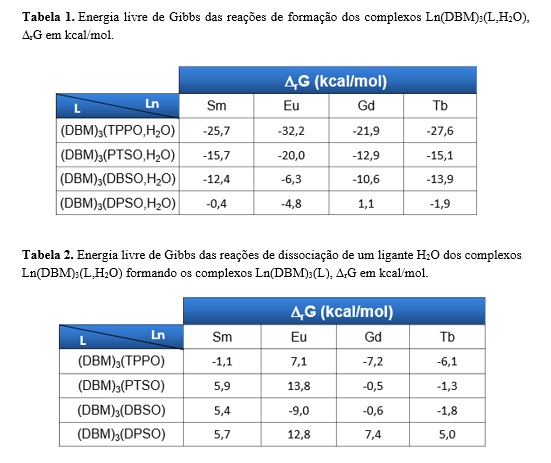
A tabela 1 apresenta os valores calculados para a energia livre de Gibbs de
formação dos complexos Ln(DBM)3(L,H2O) e a tabela 2 os de eliminação da água
de suas estruturas. No âmbito de comparação, realizamos as combinações
possíveis entre os diferentes tipos de átomos centrais lantanídicos e
ligantes de óxidos de fosfina/sulfóxidos.
Observamos a partir da tabela 1 que a preparação dos complexos de ligantes
não-iônicos mistos, Ln(DBM)3(L,H2O) torna-se progressivamente mais
favorável em termos da espontaneidade da reação para a seguinte ordem:ΔrG
[Ln(DBM)3(DPSO,H2O)]< ΔrG [Ln(DBM)3(DBSO,H2O)]< ΔrG [Ln(DBM)3(PTSO,H2O)]<
ΔrG [Ln(DBM)3(TPPO,H2O)]. Nenhuma relação linear de variação da energia
livre de Gibbs de reação foi constatada dentro do período dos lantanídeos.
Em relação à espontaneidade das reações de dissociação do ligante H2O
coordenado ao íon lantanídeo, constatamos que o fenômeno estudado não é uma
particularidade dos complexos de térbio(III) com TPPO, na realidade tanto o
samário(III) quanto o gadolínio(III) seguiram a mesma tendência para esse
ligante e, para os da classe dos sulfóxidos, o DBSO (à exceção do
samário(III)) foi o que apresentou maior espontaneidade entre os ligantes
considerados.
Estrutura química dos ligantes DBM, DBSO, DPSO, TPPO e PTSO.
Conclusões
Os nossos resultados mostraram que a formação dos complexos Ln(DBM)3(L,H2O) é mais favorável termodinamicamente quando os ligantes são sucessivamente, em ordem crescente de espontaneidade: DPSO<DBSO<PTSO<TPPO. Já em relação aos complexos Ln(DBM)3(L), o TPPO é o ligante que apresenta maior estabilidade para os metais de transição interna considerados, com exceção do európio(III), para este o DBSO se destacou aos demais.
Agradecimentos
Os autores agradecem ao PET-Química/UFPE, ao CNPq, à PROAES/UFPE e ao PRONEX/FACEPE.
Referências
Referências
N.B.D. Lima, S.M.C. Gonçalves, S. A Júnior, A. M. Simas, Sci., Rep., 2013, 3, 2395.
F. A. Silva Jr, H. A. Nascimento, D. K. S. Pereira, E. E. S. Teotonio, H. F. Brito, M. C. F. C. Felinto, J. G. P. E., G. F. Sá, W.r M. F. J. Braz. Chem. Soc., Vol. 24, No. 4, 2013, 601-608.
Filho, M. a. M.; Dutra, J. D. L.; Rocha, G. B.; Freire, R. O.; Simas, RSC Adv.2013, 3, 16747.


















