ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Rocha, A.C.C. (UFERSA) ; Pereira, C.S. (UFERSA) ; Menezes, F.L.G. (UFERSA) ; Silva, H.F.M. (UFERSA) ; Vitoriano, J.O. (UFERSA) ; Junior, C.A. (UFERSA)
Resumo
Nos últimos anos o plasma vem sendo utilizado como fonte energética da eletrólise e tem mostrado um grande potencial na degradação de substâncias orgânicas e gerar oxidação de íons inorgânicos na água. Diferente dos métodos convencionais os eletrodos não são consumidos durante o processo de eletrolise por descarga luminescente, favorecendo um maior grau de pureza. Este trabalho propõe a inovação na obtenção de gás cloro utilizando eletrólise por descarga luminescente (GDE), onde o jato de plasma atuará como anodo não consumível. Foi realizada eletrólise de uma solução de água com 30 g/l de NaCl(cloreto de sódio). Com esse novo processo foi possível verificar a produção de gás cloro através da dissociação do NaCl utilizando plasma por descarga luminescente.
Palavras chaves
ELETRÓLISE; PLASMA; GÁS CLORO
Introdução
De todo sal produzido no Brasil, mais de 90% dessa produção se encontra no estado do Rio Grande do Norte, devido à combinação de fatores importantes como relevo, clima, solo, ventos, salinidade elevada da água marinha nos estuários que proporcionam altas taxas de evaporação, basicamente nas cidades de Macau e Areia Branca (ARAÚJO et al., 2011). A eletrólise do cloreto de sódio na forma ígnea produz gás cloro e sódio, já a eletrólise do sal em meio aquoso produz os gases cloro, hidrogênio e soda cáustica. Na eletrólise contendo cloretos salinos, o gás cloro é um importante produto no anodo (ABDEL-AAL et al., 1993). As aplicações do cloro são muito diversificadas, a ponto de lhe valerem o título de reagente mais empregado na indústria química: participa na produção de 60% de todos os produtos químicos de importância comercial e de 85 % dos produtos farmacêuticos. (MONTENEGRO et al., 2009, p. 1). Os processos convencionais de produção simultânea de cloro e soda são por meio da eletrólise e usa eletrodos do tipo eletrodo intermediário de mercúrio, tipo diafragma e membrana. O problema nesses processos, é que à medida que vai ocorrendo à eletrólise, os eletrodos vão sendo consumidos, mudando o grau de pureza (CERQUEIRA et al., 2011). Se uma descarga elétrica é passada para uma solução a partir de um eletrodo condutor situado no espaço acima da superfície, notáveis reações químicas podem ser conseguidas no liquido e o processo é referido como a eletrólise descarga luminescente (GDE) (A. HICKLING, 1964).O objetivo desse estudo é aplicar um eletrodo que não seja consumível (plasma por descarga luminescente) na produção de cloro-soda.
Material e métodos
A eletrólise foi conduzida em uma célula eletrolítica dividida em dois compartimentos (cátodo e ânodo), com uma tampa de borossilicato, devidamente furados para inserção dos eletrodos e saídas dos gases. Também foi confeccionada uma membrana a partir de fitas de teflon. Durante os ensaios empregou-se uma fonte de alta tensão cuja tensão de entrada é de 220 V e tensão de saída podendo alcançar até 1000 V. Conectados a essa fonte, tem-se dois multímetros, um em serie com o sistema, conectado no cátodo e no ânodo para medir a corrente do sistema, e o outro ligado ao eletrodo do ânodo, ficando em paralelo ao sistema medindo a tensão entre os eletrodos. A solução aquosa utilizada no ânodo foi 30 g/L de NaCl (saturação da água do mar) e a solução do cátodo foi uma solução aquosa de 44,8 g/L de NaOH (hidróxido de sódio). As análises de condutividade e pH foram realizadas nessas soluções, afim de comparar as soluções antes e depois da descarga do plasma. Para isso foi usado um condutivímetro de bancada modelo mCA 150 e pHmetro de marca Tecnal e modelo Tec-3MP. A saída do gás foi conectada numa bureta, que estava ligada a um exaustor, afim de controlar a pressão no interior da mesma. Para detectar a presença de gás cloro nessa bureta contem nitrato de prata (AgNO3) padronizado. O nitrato de prata irá reagir com o cloro e formará um precipitado branco, indicando a formação do gás cloro no eletrodo do anodo,após a eletrólise alíquotas da solução foram analisadas por espectrofotometria.
Resultado e discussão
Durante o processo de eletrólise foi observada uma descarga luminescente na
cor alaranjada devido ao jato de plasma aplicado pelo eletrodo de tungstênio
localizado no primeiro furo da esquerda, conforme ilustrada(figura 1).
O gás proveniente da eletrólise foi direcionado para uma solução de nitrato
de prata. Quando o gás passava nessa solução, a mesma ficava com uma
coloração branca leitosa e turva. Na análise por espectrofotometria dessa
solução (figura 2) percebeu-se um aumento da absorbância com o tempo de
eletrólise, o
que sugere à precipitação do cloreto de prata segundo a reação, o que
comprova a presença de gás cloro e uma maior geração do mesmo para maiores
tempos de eletrolise:
3 Cl2(g) + 5 AgNO3(aq) + 3 H2O(l) → 5 AgCl(S) + HClO3(aq) + 5 HNO3(aq)
O plasma aplicado no sistema ocasionou a dissociação do NaCl e a
autoionização da agua e a formação do cloro:
2NaCl(s) → 2Na+(aq) + 2Cl-(aq)
2H2O(l) → 2H+(aq) + 2OH-(aq)
2Cl-(aq) → Cl2(g) + 2e
Alguns íons podem concorrer com o íon cloreto, a exemplo, o íon hidroxila,
na eletrogeração do oxigênio:
4OH-(aq)→ O2(g) + 2H2O(l) +4e
O cloro eletrogerado na reação principal pode ser consumido em reações não
desejadas, até que ocorra a saturação:
Cl2(g) + OH-(aq)⇔ Cl-(aq) + HClO(aq)
O ácido hipocloroso pode sofre hidrólise formando íons hipoclorito, podendo
ocorrer à formação de cloratos a partir da reação do ácido hipocloroso com
íons hipoclorito:
HClO(aq) + H2O(l) ⇔ H+(aq) + ClO-(aq)
ClO-(aq) + 2HClO(aq) ⇔ 2H+(aq) + ClO3-(aq) + Cl-(aq)

Aparato experimental no momento em que esta ocorrendo à eletrólise
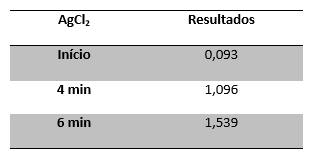
Valores da absorbância analisada no espectrofotômetro
Conclusões
O método de eletrólise com eletrodo do ânodo substituído por jato de plasma mostrou ser eficaz na eletrólise de salmoura, onde foi confirmada a produção do cloro,com uma maior geração do mesmo para maiores tempos de eletrólise.
Agradecimentos
Capes,CNPq e UFERSA
Referências
ABDEL-AAL, H. K.; HUSSEIN, I. A. Parametric study for saline water electrolysis: part Ii--chlorine evolution, selectivity and determination, 1993.
Araújo, Lorena et al. Implicações socioespaciais da indústria salineira no município de Macau/RN. 62.ed. Rio Grande do Norte: SBPC,2011. 1p.
CERQUEIRA, Alexandre Andrade; MARQUES, MR da C.; RUSSO, Carlos. Avaliação do processo eletrolítico em corrente alternada no tratamento de água de produção. Quim. Nova, v. 34, n. 1, p. 59-63, 2011.
HICKLING, M. D. I. Glow-discharge electrolysis. v. 8, n. 1, p. 65–81, July 1964 1964. Disponível em: < http://dx.doi.org/10.1016/0022-0728(64)80039-5 > Acesso no dia 15 de dezembro de 2014.
Montenegro, Ricardo et al. Produção soda-claro. 7.ed. Brasília: BNDES,1998. 20p.


















