ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Mendonça, T.L.F. (UEG-CCET) ; Mendonça, M.A.G. (UEG-CCET) ; Andrade, C.C. (UEG-CCET) ; Oliveira, M.S. (UEG-CCET) ; Costa, M.B. (UEG-CCET)
Resumo
O estudo do potencial antioxidante de guanidinas tem demonstrado grande importância devido a enorme gama de doenças degenerativas, causada pelo estresse oxidativo de biomoléculas. Este trabalho foi desenvolvido no LASIMCO UEG/CCET e teve como objetivo principal, a síntese e a avaliação do potencial antioxidante frente ao método colorimétrico DPPH da guanidina Etil-{bis[(4-metoxifenil)-amino]-metilideno}-carbamato. A guanidina apresentou CI50=14,77 mg/L e CI50=16,56 mg/L, com incubação de 1 hora e 24 horas, respectivamente, frente ao DPPH. A CI50 dos ensaios evidencia que com o tempo de incubação de 24 horas a guanidina demonstrou maior potencial antioxidante. Observa-se também, que a inibição do DPPH está diretamente ligada aos substituintes retiradores de elétrons presentes na guanidina.
Palavras chaves
Inibição; Grupos retiradores; Guanilação
Introdução
Atualmente, têm-se vários indícios do papel essencial dos radicais livres e a variedade de oxidantes responsáveis por doenças, quando associadas ao envelhecimento (SOUZA et al., 2007). Espécies reativas de oxigênio geradas de subprodutos de reações metabólicas, iniciam reações oxidativas tóxicas em biomoléculas, causando o estresse oxidativo, este associado a diversas patologias, tais como, a neurodegeneração, inflamação, doenças cancerosas e doenças cardiovasculares (SAID et al., 2013). As guanidinas são compostos nitrogenados, presentes em muitos produtos naturais ou sintetizados (WONG, 2010). Elas possuem propriedades antioxidantes para reduzir a tensão oxidativa, quando induzida no soro do sangue e no tecido cerebral, que propicia um papel de neuroprotetor (MAKEEVA, 2010). O amplo espectro de atividades biológicas, apresentadas pelos compostos guanidínicos, torna o composto um interessante alvo sintético (CUNHA, 2001). Seu caráter básico direciona para que possam ser facilmente protonadas em pH fisiológico (CAI, 2013). Dentre os métodos empregados para a determinação do potencial antioxidante, destaca-se o método colorimétrico com DPPH, rápido e acessível, definido pelo sequestro do radical 2,2-difenil-1-picril-hidrazil (MILOS et al., 2004). A molécula de DPPH é caracterizada como um radical livre estável em virtude da deslocalização do elétron desemparelhado, assim, se uma determinada molécula sequestrar o radical presente no DPPH (coloração violeta), reduzindo-o a hidrazina (coloração amarela), a mesma apresenta potencial antioxidante (ALVES et al, 2010). Em suma, este trabalho teve como objetivo principal, a síntese e determinação do potencial antioxidante, frente ao teste DPPH, da guanidina Etil-{bis[(4-metoxifenil)-amino]-metilideno}-carbamato.
Material e métodos
A guanidina foi sintetizada no LASIMCO, Laboratório de Síntese, Isolamento e Modificação de Compostos Orgânicos (UEG/CCET), caracterizada por ponto de fusão e espectroscopia de absorção no infravermelho (IV). A metodologia sintética de guanilação utilizada foi a partir de adaptações das metodologias de Cunha e colaboradores (2001) e O’Donovan e colaboradores (2011). As amostras para avaliação da atividade antioxidante foram preparadas a partir da solução estoque em metanol da guanidina, variando as concentrações de 1,7; 3,3; 8,3; 16,7; 25,0; 33,3; 66,7 e 100 mg/L. Adicionou-se 2,7 mL de solução de DPPH 40 mg/L em metanol, agitou-se e incubou-se a mistura reacional por 1 hora e 24 horas, em temperatura ambiente, sobre abrigo da luz. Em seguida realizou-se a leitura das misturas reacionais em espectrofotômetro UV/Vis (Spectrometer Lambda 25, PerkinElmer) em 517 nm, contra um branco específico constituído de 3 mL de metanol. As análises foram realizadas em triplicata para cada teste. E para a determinação da porcentagem de inibição e do CI50 foram utilizados os valores das médias obtidas das triplicatas de cada teste. Utilizou-se como padrão a rutina. A concentração da amostra na mistura reacional foi determinada pela seguinte equação: Concentração da amostra: [(concentração da solução estoque)x(Volume utilizado da solução estoque)]/ (3 mL) A porcentagem de inibição da concentração inicial do radical DPPH foi determinada pela seguinte equação: % de inibição= [(absorvância do controle – absorvância da amostra)/absorvância do controle] x 100 No qual a absorvância do controle é dada pela a absorbância de 2,7 mL de DPPH 40 mg/L mais 300 μL de metanol.
Resultado e discussão
Foi realizada a síntese e determinação da atividade antioxidante pelo teste
colorimétrico de DPPH da guanidina Etil-{bis[(4-metoxifenil)-amino]-
metilideno}-carbamato (Figura 1).
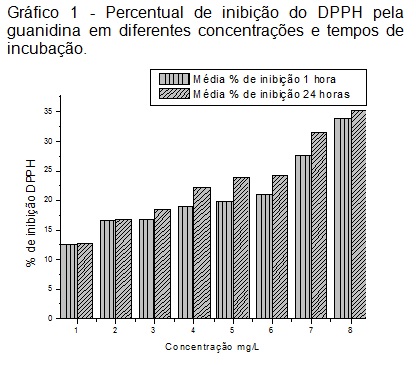
A porcentagem de inibição da amostra frente ao DPPH aumentou com a diferença
de tempo, até as concentrações mais altas (Gráfico 1) (ANDRADE et al.;
2007). Os valores do CI50, através de regressão linear dos pontos, foram de
CI50=14,77 mg/L (1h) e CI50=16,56 mg/L (24h) e evidenciaram que o tempo de
incubação de 24 horas possui atividade antioxidante mais acentuada frente ao
CI50 da rutina (6,7 mg/L), utilizada como padrão. Os resultados indicam que
eliminação do DPPH é dependente do tempo, e um processo relativamente lento.
Observa-se também que a inibição do DPPH está diretamente ligada pelos
substituintes retiradores de elétrons presentes na guanidina.
A guanidina apresentou potencial antioxidante satisfatório pelo método
espectrométrico de descoloração do radical DPPH quando comparado com o
padrão utilizado no ensaio.
Conclusões
Os resultados apresentados indicam que a guanidina sintetizada Etil-{bis[(4- metoxifenil)-amino]-metilideno}-carbamato, apresentou potencial antioxidante quando submetida ao teste colorimétrico de DPPH, 2,2-difenil-1-picril- hidrazil. O potencial antioxidante da guanidina variou com diferentes tempos de incubação, onde foi observado que com um tempo de 24 horas obteve-se maior potencial antioxidante do que com apenas 1 hora. Observou-se que este processo lento, pode estar diretamente ligado aos grupos retiradores de elétrons presentes na guanidina, fato a ser verificado em futuros estudos.
Agradecimentos
FAPEG (Fundação de amparo à pesquisa do estado de Goiás) e ao grupo de pesquisa do LASIMCO, Laboratório de Síntese, Isolamento e Modificação de Compostos Orgânicos (U
Referências
ALVES, C. Q.; DAVID, J. M.; DAVID, J. P.; BAHIA, M. V.; AGUIAR, R. M.; Química Nova, v. 33, n. 10, p. 2202-2210, 2010.
ANDRADE, C. A.; COSTA, C. K.; BORA, K.; MIGUEL, M. D.; MIGUEL, O. G.; KERBER, V. A.; Revista Brasileira de Farmacognosia, v. 17, n. 2, p. 231-235, 2007.
CAI, Z. S.; SUN, Y. M.; ZHU, X. M.; ZHAO, L. L.; YUE, G. Y.; Polymers Bulletin, v. 70, p.1085-1096, 2013.
CUNHA, S. D.; COSTA, M. B.; NAPOLITANO, H. B.; LARIUCCI, C.; VENCATO, I., Tetrahedron, v. 57, p. 1671-1675, 2001.
MAKEEVA, A.V.; PPOVA, T. N.; SUKHOVEEVA, O. V.; PANCHENKO, L. F.; Neurochemistry Journal, n.4, p. 217-221, 2010.
MILOS, M.; KULISI, T.; RADONIC, A.; KATALINIC, V.;. Food Chemistry, n. 85 p. 633–640, 2004.
O’DONOVAN, D.H.; ROZAS, I, Tetrahedron Letters, v.52, p. 4117-4119, 2011.
SAID, M.; BADSHAH, A.; SHAH, N. A.; KHAN, H.; MURTAZA, G.; VABRE, B. ZARGARIAN, D.; KHAN, M. R.; Journal molecules. n. 18, p. 10378-10396, 2013.
SOUZA, C. M. de M.; SILVA, H. R.; VIEIRA-Jr. G. M.; AYRES, M. C. C.; COSTA, C. L. S.; ARAÚJO, D. S.; CAVALCANTE, L. C. D.; BARROS, E. D. S.; ARAÚJO, P. B. M.; BRANDÃO, M. S.; CHAVES, M. H.; Química Nova, v. 30, n. 2, p. 351-355, 2007.
WONG, F. F.; CHEN, C. Y.; LIN, H. C.; HUANG, Y. Y.; CHEN, K. L.; HUANG, J. J.; YEH, M. Y.; Tetrahedron, v. 66, p. 1892-1897, 2010.


















