ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Costa, A.R.S. (IFBA) ; Fontineles, T.A.C. (IFBA)
Resumo
Neste trabalho, simulações de dinâmica molecular foram realizadas com o objetivo de estudar o comportamento dinâmico de peptídeos análogos à Angiotensina II com atividade antiplasmódica. Foi utilizado o programa Amber 12 e o campo de força ff99SB, específico para modelar aminoácidos. Dinâmicas com tempo de 20 ns foram feitas para a angiotensina II em solução aquosa, além de mais três peptídeos análogos a ela. Resultados obtidos das simulações, tais como formação de ligações de hidrogênio e o desvio médio quadrático (RMSD), mostraram que houve uma grande modificação estrutural entre os análogos da Angiotensina II, sendo estes peptídeos mais flexíveis e com estruturas mais compactadas, fatores que melhoram a ação antimicrobiana no rompimento das membranas lipídicas.
Palavras chaves
angiotensina; peptídeo; dinâmica
Introdução
A dinâmica molecular é uma ferramenta computacional que tem sido muito utilizada, principalmente para o planejamento de fármacos. Ela se baseia nos princípios da mecânica clássica e fornece informações do comportamento dinâmico dos átomos que compõe o sistema em análise. Para a obtenção das propriedades macroscópicas do sistema em estudo, é necessária a aplicação da mecânica estatística, sendo que esta tem a função de calcular estatisticamente, propriedades como pressão, energia interna, temperatura, entropia, entre outros. Neste trabalho, simulações de dinâmica molecular foram utilizadas para investigar as mudanças estruturais e as interações de biomoléculas análogas ao peptídeo angiotensina II em solução. A angiotensina II é um peptídeo natural composto por uma sequência de oito aminoácidos (MACIEL et. al, p. 3296, 2008). Essa substância possui uma ação antiplasmódica de 88%, porém não pode ser utilizada como fármaco por possuir grande atividade pressora (FYHRQUIST & SAIJONMA, p. 224, 2008). A malária é uma doença infecciosa cujo agente causador é o protozoário do gênero Plasmodium. Vários agentes quimioterápicos tem sido estudados e empregados no combate a esta doença, porém, como muitos apresentam efeitos colaterais graves e outros tornaram-se ineficazes devido à grande resistência do plasmódio, faz-se necessário o estudo de novos compostos com atividade antimalárica (FRANÇA et. al, p. 1271, 2008). Essa nova linha de pesquisa, voltada ao combate da malária, é de grande relevância científica, já que apresenta a utilização de um peptídeo que, apesar de não apresentar atividade antimicrobiana e hemolítica, é específico na ação lítica sobre a membrana do esporozoíta da malária.
Material e métodos
Foram obtidas três estruturas de peptídeos análogos da Angiotensina II (AII inv, DAII e DAII inv), a partir de uma estrutura cristalográfica retirada do Protein Data Bank (PDB:1N9V). As coordenadas iniciais das estruturas obtidas serviram como ponto de partida para gerar as topologias, que foram feitas através do pacote xleap dentro do programa Amber 12. Cada sistema (peptídeo em solução aquosa) foi solvatado por moléculas de água (4.982), utilizando o modelo TIP3P em uma caixa retangular de dimensões (X=41.027 Å, Y=38.729 Å e Z=46.255 Å) de comprimento. Utilizou-se o campo de força ff99SB que é específico para modelar aminoácidos, tais como os peptídeos do sistema.As topologias obtidas foram então utilizadas para realizar a etapa de minimização (otimização) das estruturas, afim de eliminar possíveis maus contatos estéricos. Na etapa da minimização, foi utilizado um raio de corte de 10 Å e uma força de 400 kcal/mol para a restrição da posição dos átomos do peptídeo no sistema. Com o sistema já minimizado, passou-se para a etapa de termalização, onde o sistema foi previamente aquecido a uma temperatura de 0 a 300K em um passo de 2 ps sob pressão constante. Após a etapa de termalização, realizou-se a etapa de produção da dinâmica deixando o sistema fluir nas condições de NPT. Nessa etapa, o sistema foi tratado sob condições periódicas de contorno a 1 atm de pressão e 300K. O tempo de simulação em cada sistema foi de 20 ns ou 107 passos de simulação. Para extrair os resultados provenientes das simulações de dinâmica, foi utilizado o módulo ptraj, contido na suíte do programa Amber 12. Após isso, foi utilizado o programa xmgrace para extrair os gráficos de RMSD e histogramas de algumas propriedades dos sistemas analisados.
Resultado e discussão
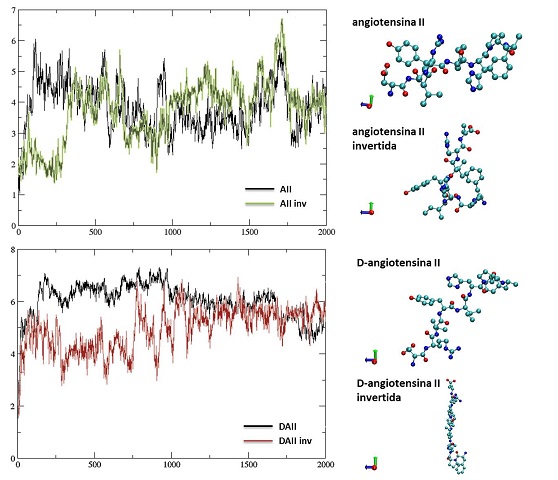
A figura 1 mostra os gráficos de rmsd em função do tempo após a realização
das simulações de dinâmica. O primeiro gráfico demonstra o quanto a
estrutura da AII variou durante a simulação, onde se observa
que entre 10 e 15 ns há uma estabilidade na estrutura, porém, voltando a
variar novamente depois deste intervalo, demonstrando pouca estabilidade do
composto e grande flexibilidade do sistema, pois há uma variação de 1 à 6 Å
ao longo da simulação. Foi encontrada uma ligação de hidrogênio
intramolecular nesse composto. Já para a AII invertida, o gráfico de rmsd
demonstra o comportamento diferenciado em relação à AII. Este resultado
caracteriza uma maior variação do desvio médio quadrático em função do tempo
do que a AII, demonstrando uma maior flexibilidade do sistema e também uma
menor estabilidade, comprovando que os dois compostos possuem diferentes
comportamentos em uma mesma condição. Neste análogo não foi encontrada
nenhuma ligação de hidrogênio intramolecular.O segundo gráfico na figura 1
mostra o rmsd do análogo D-AII e D-AII invertida. Analisando o gráfico,
pode-se perceber uma maior estabilidade do primeiro composto, já que sua
variação de rmsd foi menor do que dos outros
compostos, sem grandes picos de variação. A rigidez deste composto é
confirmada a partir da pequena variação que ocorre de seu rmsd. Duas
ligações de hidrogênio foram encontradas em ambos os compostos, mostrando
que estes são mais estáveis do que a conformação AII e AII invertida. Ambas
as ligações de hidrogênio permanecem por mais de 30% do tempo de simulação
com uma distância média de 2,5 Å, o que se pode constatar que essas ligações
intramoleculares contribuem para a estabilidade e maior rigidez dos composto
DAII e DAII inv.
Conclusões
De acordo com os resultados obtidos é possível concluir que as estruturas análogas à angiotensina II apresentaram diferentes comportamentos quando expostos a iguais condições. Além disso, pode-se perceber que há uma grande modificação estrutural entre os análogos da Angiotensina II. Dados comprovados nos gráficos de rmsd mostraram que os peptídeos análogos possuem uma estrutura mais compactada e menos flexível, fatores estes que melhoram a ação desses peptídeos antimicrobianos no rompimento das membranas lipídicas.
Agradecimentos
Os autores agradecem ao IFBA pela bolsa concedida ao estudante e ao Cenapad pelo suporte técnico, possibilitando a realização das simulações.
Referências
FRANÇA, T. C. C.; SANTOS, M. G.; FIGUEROA-VILLAR, J. D. Malária: aspectos históricos e quimioterapia. Química Nova, nº 31, 2008.
FYHRQUIST, F.; SAIJONMA, O. Renin-angiotensin System Revisited. Journal of Internal Medicine, nº 264, 224-236, 2008.
MACIEL, C.; OLIVEIRA, V. X.; FÁZIO, M. A.; NACIF, R. P.; MIRANDA, A.; PIMENTA, P. F.; CAPURRO, M. L. Anti-plasmodium activity of angiotensin II and related synthetic peptides. Plos One, nº 3, 3296, 2008


















