ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
H. S. D. Silva, H. (UFPE) ; B. D. Lima, N. (UFPE) ; L. C. Moura, G. (UFPE)
Resumo
A ftalimida, o tautômero ftalimídico e os seus respectivos complexos formados via ligação de hidrogênio por ácidos carboxílicos, RCOOH (R= -CH3, -H, e - CF3), foram estudados usando o cálculo da Teoria do Funcional da Densidade (DFT) PBE1PBE/6-31++G(d,p) e B3LYP/6-31++G(d,p) e o programa de química quântica Gaussian 2009. Os resultados encontrados mostram que em condições normais a ftalimida é energeticamente mais estável que seu tautômero. Entretanto, em todos os casos estudados, os resultados inferem que quando complexadas com ácidos carboxílicos, a forma tautomérica da ftalimida leva a complexos mais estáveis do que aqueles envolvendo ftalimida.
Palavras chaves
Aspectos termodinâmicos ; ftalimida; ligação de hidrogênio
Introdução
A ftalimida, quando ministrada em doses de 20 mg/kg-1 dia-1, apresenta atividade biológica de redução da taxa de colesterol e da taxa de triglicerídeos (CHAPMAN et al, 1979). Neste contexto, a possibilidade de tautomerização da ftalimida pode representar um fator importante neste tipo de atividade. É conhecido que a tautomerização de compostos orgânicos pode ser catalisada via ligações de hidrogênio (KORTH et al, 2012). Assim, avaliou-se neste trabalho, a possibilidade de reação de tautomerização da ftalimida via interação com ácidos carboxílicos, tendo como objetivo principal o estudo das propriedades termodinâmicas, energia da ligação de hidrogênio e energia livre de Gibbs, das reações de complexação entre a ftalimida ou seu tautômero e ácidos carboxílicos, RCOOH (R= -CH3, - H, e -CF3).
Material e métodos
Utilizou-se como metodologia a Teoria do Funcional da Densidade (DFT) (BECKE, et al, 1993) com os funcionais PBE1PBE e B3LYP. O conjunto de funções base escolhido foi o 6-311++G(d,p). Realizou-se, inicialmente, cálculos de otimização de geometria seguidos de cálculos das frequências de infravermelho de todos os sistemas para determinação teórica das propriedades termodinâmicas dos complexos: energia da ligação de hidrogênio e energia livre de Gibbs de reação. Todos os cálculos foram realizados utilizando o programa de química quântica GAUSSIAN 2009 (FRISCH et al, 2009).
Resultado e discussão
Inicialmente, analisou-se o equilíbrio químico entre a ftalimida (FTA) e sua
espécie tautômerica (TAU), figura 1. A partir deste, tem-se que a ftalimida
livre de complexação é energeticamente mais estável quando comparada ao seu
tautômero. Entretanto, ao interagir com os ácidos carboxílicos, RCOOH (R= -
CH3, -H, e -CF3), a espécie predominantemente mais estável passa a ser a
tautomérica, como apresenta os valores de energia da ligação de hidrogênio
sem correção (∆E), com correção da energia do ponto zero ZPE (ΔEZPE), bem
como em termos de espontaneidade de reação (∆rG), tabela 1.
Em todos os casos verificou-se que as estruturas não possuem frequências
imaginárias, indicando desta forma que as mesmas correspondiam a pontos de
mínimo na curva de energia potencial.
Através da Tabela 1, pode-se constatar que dentre os complexos analisados, o
energeticamente mais estável é FT˖˖˖HOOCCF3, cujo valor de ΔEZPE é -60,8
kJ.mol-1, já o complexo correspondente envolvendo o tautômero,
TAU˖˖˖HOOCCF3, o valor de ΔEZPE é -147,0 kJ.mol-1. Esta diferença estende-se
à espontaneidade da reação, onde considerando mais uma vez o complexo
FT˖˖˖HOOCCF3, o valor de ∆rG é -14,3 kJ.mol-1, já o complexo correspondente
envolvendo o tautômero, TAU˖˖˖HOOCCF3, o valor de ∆rG é -100,5 kJ.mol-1.
Todos estes para o nível de cálculo PBE1PBE/6-31++G(d,p). Realizou-se
simultaneamente, para fins de verificação, um segundo método com nível de
cálculo B3LYP/6-31++G(d,p), tabela 1, sendo este fundamental para a
confirmação de que complexos do tipo TAU˖˖˖HOOCR, (R= -CH3, -H, e -CF3), são
termodinamicamente mais estáveis que complexos envolvendo FTA˖˖˖HOOCR. Como
exemplo destacou-se novamente TAU˖˖˖HOOCCF3 e FT˖˖˖HOOCCF3, tabela 1.
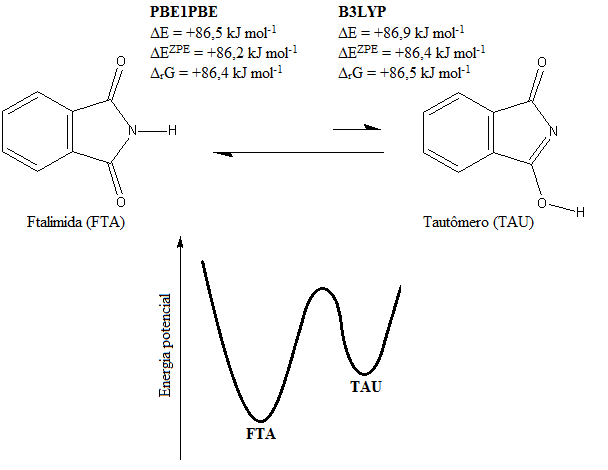
Equilíbrio químico entre ftalimida (FTA) e seu respectivo tautômero (TAU).
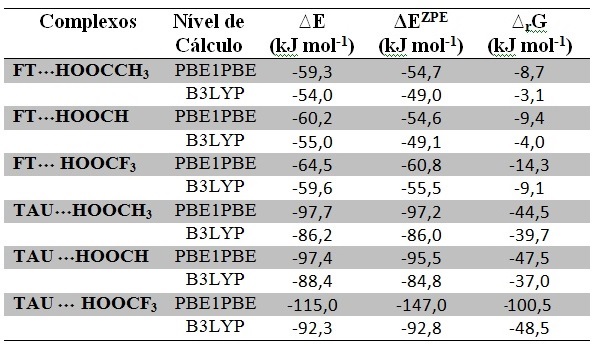
Valores calculados da energia sem correção (∆E), com correção da energia do ponto zero ZPE (ΔEZPE) e das energias livres de Gibbs de reação (ΔrG).
Conclusões
Verificou-se a partir de cálculos das propriedades termodinâmicas que a ftalimida livre de complexação é energeticamente mais estável que seu tautômero. Também constatou-se, que dentre os complexos FTA˖˖˖HOOCR e TAU˖˖˖HOOCR, (RCOOH (R= -CH3, -H, e -CF3)), os que mais destacam-se energeticamente em todos os casos são os envolvendo complexos na forma tautomérica para ambos os níveis de cálculo PBE1PBE/6-31++G(d,p) e B3LYP/6- 31++G(d,p) com destaque para TAU˖˖˖HOOCCF3.
Agradecimentos
Os autores agradecem ao CNPq, à PROAES/UFPE e ao PRONEX/FACEPE.
Referências
J. M. CHAPMAN, G. H. COCOLAS and I. H. HALL, J. Med. Chem., 22, 1399, 1979.
H. G. KORTH and P. MULDER, Anthrone and Related Hydroxyarenes: Tautomerization and Hydrogen Bonding, J. Org. Chem. , 78 (15), 7674, 2013.
A.D. BECKE, Density‐functional thermochemistry. III. The role of exact Exchange. J. Chem. Phys., Vol. 98, P. 5648, 1993.
M. J. FRISCH, G. W. TRUCKS, H. B. SCHLEGEL, G. E. SCUSERIA, M. A. ROBB, J. R. CHEESEMAN, G. SCALMANI, V. BARONE, B. MENNUCCI, G. A. PETERSSON, H. NAKATSUJI, M. CARICATO, X. LI, H. P. HRATCHIAN, A. F. IZMAYLOV, J. BLOINO, G. ZHENG, J. L. SONNENBERG, M. HADA, M. EHARA, K. TOYOTA, R. FUKUDA, J. HASEGAWA, M. ISHIDA, T. NAKAJIMA, Y. HONDA, O. KITAO, H. NAKAI, T. VREVEN, J. A. MONTGOMERY, JR., J. E. PERALTA, F. OGLIARO, M. BEARPARK, J. J. HEYD, E. BROTHERS, K. N. KUDIN, V. N. STAROVEROV, R. KOBAYASHI, J. NORMAND, K. RAGHAVACHARI, A. RENDELL, J. C. BURANT, S. S. IYENGAR, J. TOMASI, M. COSSI, N. REGA, J. M. MILLAM, M. KLENE, J. E. KNOX, J. B. CROSS, V. BAKKEN, C. ADAMO, J. JARAMILLO, R. GOMPERTS, R. E. STRATMANN, O. YAZYEV, A. J. AUSTIN, R. CAMMI, C. POMELLI, J. W. OCHTERSKI, R. L. MARTIN, K. MOROKUMA, V. G. ZAKRZEWSKI, G. A. VOTH, P. SALVADOR, J. J. DANNENBERG, S. DAPPRICH, A. D. DANIELS, Ö. FARKAS, J. B. FORESMAN, J. V. ORTIZ, J. CIOSLOWSKI, and D. J. FOX, Gaussian 09, Revision D.01. Gaussian, Inc., Wallingford CT, 2009.


















