Purificação simultânea de C-ficocianina e anidrase carbônica utilizando precipitação fracionada por sal
ISBN 978-85-85905-21-7
Área
Alimentos
Autores
Jantzen da Silva Lucas, A. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Simões Corrêa Junior, L.C. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Sala, L. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Juliano Kalil, S. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
Resumo
O objetivo do presente estudo foi purificar simultaneamente, a partir do extrato de biomassa úmida de Spirulina platensis LEB-52, os bioprodutos C-ficocianina (C-FC) e anidrase carbônica (AC) utilizando precipitação fracionada. A microalga foi cultivada em meio Zarrouk 100%, a extração foi assistida por ultrassom e a purificação simultânea dos bioprodutos foi realizado por precipitação fracionada com sulfato de amônio nas faixas de saturação de 0-20%/ 20-50%. Conforme esperado, a C-FC foi recuperada na fração precipitada com pureza de grau alimentar (0,78), e a AC foi recuperada no sobrenadante com atividade enzimática de 0,14 U/mL. Pode-se concluir que é possível obter dois bioprodutos purificados através de uma única técnica de purificação.
Palavras chaves
[i]Spirulina[/i]; Purificação; Precipitação
Introdução
O crescente interesse no estudo de micro-organismos como microalgas, fungos e bactérias deve-se à importância destes nas diversas cadeias tróficas e na possibilidade da aplicação comercial em distintas áreas como na nutrição, saúde humana e animal, no tratamento de águas residuais, na produção de energia e na obtenção de compostos de interesse das indústrias alimentícia, química e farmacêutica, dentre outras (DERNER, 2006). Dentre os diversos compostos que podem ser obtidos da biomassa de Spirulina destacam-se a anidrase carbônica (AC) e a C-ficocianina (C-FC) (ORES; AMARANTE; KALIL, 2016). A C-FC é uma ficobiliproteína que pode ser utilizada como pigmento natural em alimentos, tais como goma de mascar, produtos lácteos, geleias (SANTIAGO- SANTOS et al., 2004), sorvetes, sobremesas e bebidas não alcoólicas (SONANI et al., 2016), também apresentam uma variedade de efeitos benéficos a saúde, como ação antioxidante, anti-inflamatória (DENG; CHOW, 2010), antitumoral (LI et al., 2015), dentre outros. A anidrase carbônica (EC 4.2.1.1) é uma metaloenzima, que contém um átomo de zinco na sua conformação, e catalisa a hidratação reversível do CO2 em bicarbonato com alta eficiência (SHEKH et al., 2012), sendo utilizada industrialmente em sistemas de captura enzimática de CO2 atmosférico (VINOBA et al., 2012), poluente considerado como maior contribuinte para o efeito estufa (IPCC, 2001). No processo enzimático de captura de CO2, ocorre primeiramente a hidratação do CO2, catalisada pela enzima e posterior fixação química na forma de carbonato, este é um método seguro e permanente de eliminação de CO2, pois os mesmos encontram-se em abundância na natureza e são ambientalmente seguros e estáveis (MIRJAFARI; ASGHARI; MAHINPEY, 2007). Devido as diversas aplicações em vários campos, torna-se essencial desenvolver um método fácil e rentável para a purificação de bioprodutos de origem microalgal a fim de atender a crescente demanda (BERMEJO ROMÁN et al., 2002). A purificação de produtos biotecnológicos pode envolver etapas de precipitação, ultrafiltração, sistema aquoso bifásico, ou a combinação destes, seguidos de uma ou mais etapas cromatográficas, como cromatografia de troca iônica, de afinidade, de interação hidrofóbica ou de adsorção. A finalização geralmente é feita com etapa de filtração em gel, secagem, cristalização ou liofilização do produto de interesse (KILIKIAN; PESSOA JR, 2005). Entre os processos de purificação inicial estão a precipitação por sal ou por solvente, onde estes irão modificar a solubilidade da proteína. A precipitação é uma das operações mais adotadas, tanto em escala laboratorial quanto industrial para purificação de proteínas (LEHNINGER; NELSON; COX, 1995). O fracionamento em “dois-cortes” ou “dois-estágios” pode ser empregado quando os meios que contém a proteína a ser purificada apresentam misturas de diferentes biomoléculas, removem-se primeiro as proteínas indesejáveis, e após precipitam-se uma ou mais biomoléculas alvo. Por ser acessível economicamente, o sulfato de amônio é um dos sais mais utilizados para precipitar proteínas, podendo ser eliminado posteriormente da suspensão por diálise ou ultrafiltração para que se possa continuar com as etapas de purificação (KILIKIAN; PESSOA JR, 2005). Na literatura são encontrados trabalhos que avaliam a purificação de C-ficocianina (CHAIKLAHAN et al., 2011; FIGUEIRA, 2014; MORAES et al., 2011; PATEL et al., 2005; SILVA et al., 2009; SONI et al., 2006) e anidrase carbônica extraída a partir de microalgas (HILTONEN et al., 1995; KARLSSON et al., 1995). Ores (2014) realizou a extração conjunta de ficobiliproteínas e da enzima anidrase carbônica a partir de biomassa microalgal, no entanto até o presente momento não se tem conhecimento de estudos que purifiquem/ separem simultaneamente os dois bioprodutos. Mediante o exposto o presente trabalho teve por objetivo purificar simultaneamente, a partir do extrato de biomassa úmida de Spirulina platensis LEB-52, os bioprodutos C-ficocianina e anidrase carbônica utilizando precipitação fracionada com sulfato de amônio.
Material e métodos
A cepa de cianobactéria Spirulina platensis LEB-52, gentilmente cedida pelo Laboratório de Engenharia Bioquímica da Escola de Química e Alimentos da Universidade Federal do Rio Grande (FURG), foi utilizada para obtenção simultânea dos bioprodutos C- FC e AC. Para o preparo do inóculo, cultivo e manutenção da microalga foi utilizado o meio Zarrouk 100% (ZARROUK, 1996). Os cultivos foram realizados em Erlenmeyer de 2 L segundo Sala (2017). Ao término do cultivo, a biomassa foi recuperada por filtração em papel filtro qualitativo (Fitec) de fibra vegetal e espessura 0,2 mm, ressuspendida em tampão Tris-SO4 50 mM pH 7,4 e destinada a extração assistida por ultrassom (EAU). A EAU foi realizada utilizando homogenizador ultrassônico (Sonic Ruptor 250, Omni International Inc., EUA) com frequência de 20 kHz (ponteira micro) conforme proposto por Ores (2014). O tempo de ruptura celular foi de 12 min (SALA, 2017). Após, as suspensões foram centrifugadas e o sobrenadante utilizado para os ensaios de purificação. O extrato obtido foi concentrado e purificado por precipitação fracionada com sulfato de amônio segundo Figueira (2014), as faixas de saturação (0-20% / 20-50%) foram escolhidas de acordo com estudos feitos por Moraes (2006). Os ensaios foram realizados em triplicata. A influência do sal sobre a atividade da AC foi realizada aplicando diferentes faixas de saturação (0, 5, 7,5, 10, 12,5, 15 e 20%) no extrato bruto. A eficiência do processo foi avaliada em termos de fator de purificação e recuperação para C-FC e AC. O fator de purificação foi calculado pela razão entre a concentração específica de C-FC (mg/mg)proteína na saída e a concentração específica de C-FC (mg/mg)proteína na entrada, para AC o fator de purificação foi calculado pela razão entre a atividade específica de AC (U/mg)proteína na saída e a atividade específica de AC (U/mg) proteína na entrada. O percentual de recuperação foi calculado pela razão entre a concentração total de C-FC (mg) na saída e a concentração total de C-FC (mg) na entrada. Para AC o percentual de recuperação foi calculado pela razão entre atividade total (U) na saída e a atividade total (U) na entrada. A concentração de C-FC foi calculada como descrito por Bennett e Bogorad (1973), a pureza de C-FC foi calculada pela razão entre as absorvâncias a 620 nm e a 280 nm. A atividade enzimática da anidrase carbônica foi monitorada através da atividade de esterase segundo metodologia de Pocker e Stone (1967). A concentração de biomassa foi determinada conforme Costa et al. (2002) e conversão para biomassa seca através de curva padrão previamente preparada. A determinação de proteínas foi realizada nas frações precipitada, sobrenadante e extrato inicial segundo metodologia descrita por Lowry et al. (1951), utilizando albumina de soro bovino como padrão, e também foi acompanhada por leitura em espectrofotômetro-UV a 280 nm.
Resultado e discussão
Através dos ensaios de precipitação fracionada realizados esperava-se encontrar uma maior
concentração de C-ficocianina na fração precipitada do segundo corte (MORAES, 2006) e uma maior
atividade de anidrase carbônica na parcela do sobrenadante, possibilitando assim a separação
simultânea dos dois bioprodutos. Analisando as frações (precipitado e sobrenadante)
individualmente, pode-se perceber que a precipitação fracionada com sulfato de amônio se mostrou
uma técnica eficaz para a purificação simultânea da C-ficocianina e anidrase carbônica, uma vez
que, conforme esperado a C-ficocianina foi obtida na fração precipitada e a anidrase carbônica na
fração sobrenadante, resultados estes apresentados na Tabela 1.
C-ficocianina é comercializada de acordo com seu grau específico de pureza, que pode variar de 0,7
(grau alimentar) a 4,0 (grau analítico) (RITO-PALOMARES; NUEZ; AMADOR, 2001). Com base nos
resultados da Tabela 1, verificou-se que o processo aplicado possibilitou a obtenção de extrato de
C-ficocianina com pureza de grau alimentar (0,78) e concentração de 1,3 mg/mL. Em estudo feito por
Silva et al. (2009) valores semelhantes para pureza (0,72 e 0,88) e concentração (1,69 mg/mL e 1,66
mg/mL) de C-ficocianina foram encontrados para precipitação com 50% de saturação e
fracionamento nas faixas de 0-20% /20-50% respectivamente. Moraes (2006) reproduziu a mesma
faixa de fracionamento de Silva et al. (2009) e obteve o mesmo valor de pureza (0,88) e concentração
(1,6 mg/mL).
A recuperação de 74,9% obtida neste estudo se assemelha a recuperação de 75% obtida por Román
et al. (2002), o qual utilizou precipitação de 65% de saturação com sulfato de amônio para recuperar
ficoeritrina de Porphyridium cruentum. Figueira (2014) e Moraes (2006) utilizaram precipitação
fracionada com faixa de saturação de 0-20% / 20-50% para purificar C-ficocianina de Spirulina
platensis e obtiveram recuperação de 81,2% e 83,3% respectivamente. Silva et al. (2009) obteve
91,7% de recuperação com fracionamento na faixa de 50% de saturação a fim de purificar C-
ficocianina de Spirulina platensis.
Diversos estudos utilizam a precipitação com sulfato de amônio para purificação de enzimas
(FIGUEIRA, 2014; MOHAMED et al., 2016; MORAES et al., 2011; YAN et al., 2011; PURWANTO, 2016)
antes de se aplicar um método mais sofisticado para a purificação de uma proteína. Por outro lado, o
passo de precipitação muitas vezes provoca alterações no rendimento e na atividade da proteína. De
acordo com a Tabela 1, a enzima anidrase carbônica apresentou atividade de 0,14 U/mL, fator de
purificação de 133,8 vezes e recuperação de 976,8%, valor este muito elevado.
Partindo do pressuposto de que o sal utilizado poderia aumentar a atividade enzimática da anidrase
carbônica a influência do sal foi estudada, e os resultados obtidos estão apresentados na Figura 1. A
atividade da anidrase carbônica (U/mL) aumenta conforme o incremento na concentração de sal, isto
pode explicar os valores elevados de recuperação e purificação, uma vez que estes dois parâmetros
são dependentes da atividade enzimática.
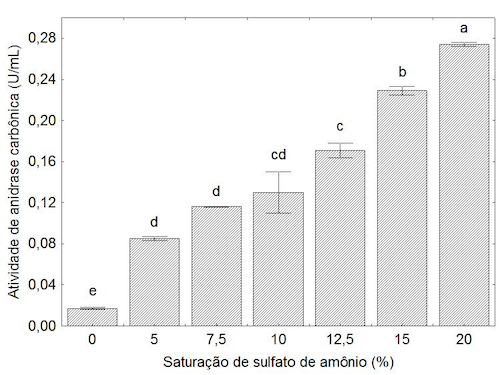
A Figura 1 mostra que o aumento na concentração de sulfato de amônio durante a precipitação promoveu o aumento da atividade da anidrase carbônica.

A Tabela 1 apresenta os valores de concentração, atividade, fator de purificação, recuperação e pureza para C-ficocianina e anidrase carbônica.
Conclusões
De acordo com o presente estudo, pode-se concluir que é possível obter dois bioprodutos purificados através de uma só técnica de purificação, uma vez que a C-ficocianina se localizou na fração precipitada e a anidrase carbônica na fração sobrenadante. Utilizando precipitação fracionada na faixa de 0-20% / 20-50% de saturação obteve-se C-ficocianina com pureza de grau alimentar (0,78), concentração de 1,3 mg/mL, recuperação de 74,9% e fator de purificação de 1,7 vezes em relação ao extrato inicial. A enzima anidrase carbônica apresentou valores de atividade enzimática de 0,14 U/mL com fator de purificação 133,8 vezes e recuperação de 976,8%, valores estes explicados devido a influência do sal sobre a atividade da enzima.
Agradecimentos
CNPq, FAPERGS, Capes e PIBIC/CNPq
Referências
BENNETT, A.; BOGORAD, L. Complementary chromatic adaptation in a filamentous blue-green alga. The Journal of Cell Biology, no 58, 419-435, 1973.
ROMÁN, R. B.; ALVÁREZ-PEZ, J. M.; FERNÁNDEZ, A. F. G.; MOLINA GRIMA, E. Recovery of pure β – phycoerythrin from the microalga Porphyridium cruentum. Journal of biotechnology, no 93, 73-85, 2002.
CHAIKLAHAN, R.; CHIRASUWAN, N.; LOHA, V.; TIA, S.; BUNNAG, B. Separation and purification of phycocyanin from Spirulina sp using a membrane process. Bioresource Technology, no 102, 7159-7164, 2011.
DENG, R.; CHOW, T. Hypolipidemic, antioxidant, and antiinflammatory activities of microalgae Spirulina.Cardiovascular Therapeutics, no 28, 33-45, 2010.
DERNER, R. B. Efeito de fontes de carbono no crescimento e na composição bioquímica das microalgas Chaetoceros muellei e Thalassiosira fluviatilis, com ênfase no teor de ácidos graxos poliinsaturados. 2006. 139 f. Tese (Doutorado em Ciências dos Alimentos) - Universidade Federal de Santa Catarina, Florianópolis - 2006.
FIGUEIRA, F. S. Purificação de C-ficocianina e sua incorporação em nanofibras. 2014. 141 f. Tese (Doutorado em Engenharia e Ciências de Alimentos) – Universidade Federal do Rio Grande, Rio Grande – 2014.
HILTONEN, T.; KARLSSON, J.; PALMQVIST, K.; CLARKE, A.; SAMUELSSON, G. Purification and characterisation of an intracellular carbonic anhydrase from the unicellular green alga Coccomyxa. Planta, no 195, 345-351, 1995.
IPCC – INTERGOVERNMENTAL PANEL ON CLIMATE CHANGE. Climate change 2001: the scientific basis. In: Houghton, J. T. (Ed.), Contribution of working group I to the fourth assessment reporto of the intergovernmental panelo in climate change. Cambridge Univ. Press, New York, p. 882, 2001.
KARLSSON, J.; HILTONEN, T.; HUSIC', D. H.; RAMAZANOV, Z.; SAMUELSSON, C. lntracellular carbonic anhydrase of Chlamydomonas reinhardtii'. Plant Physiology, no 109, 533-539, 1995.
KILIKIAN, B. V.; PESSOA JR, A. Purificação de produtos biotecnológicos. São Paulo: Ed. Manole, 2005.
LEHNINGER, A. L.; NELSON, D. L.; COX, M. M. Princípios de Bioquímica. 2 ed. São Paulo: Sarvier, 1995.
LI, B.; GAO, M.; CHU, X.; TENG, L.; LV, C.; YANG, P.; YIN, Q. The synergistic antitumor effects of all-trans retinoic acid
and C-phycocyanin on the lung cancer A549 cells in vitro and in vivo. European Journal of Pharmacology, no 749, 107-114, 2015.
LOWRY, O. H.; ROSEBROUGH, N. J.; FARR, A. L.; RANDALL, R. J. Protein measurement with the folin phenol reagent. Journal of Biological Chemistry, no 193, 265-275, 1951.
MIRJAFARI, P.; ASGHARI, K.; MAHINPEY, N. Investigating the application of enzyme carbonic anhydrase for CO2 sequestration purposes. Industrial & Engineering Chemistry Research, no 46, 921-926, 2007.
MOHAMED, M. A.; MAHDY, E. M. E.; GHAZY, A. M.; EL-MEZAYEN, H. A.; GHANEM, M. M. E. The activity of detoxifying enzymes in the infective juveniles of Heterorhabditis bacteriophora strains: Purification and characterization of two acetylcholinesterases. Comparative Biochemistry and Physiology, C, no 180, 11-22, 2016.
MORAES, C.C. Extração e purificação de C-ficocianina de Spirulina platensis. 2006. 78 f. Dissertação (Mestrado em Engenharia e Ciência de Alimentos) Universidade Federal do Rio Grande, Rio Grande – 2006.
MORAES, C. C.; ORES, J. C.; COSTA, J. A. V.; KALIL, S. J. Recovery of C-phycocyanin in the presence of cells using expanded bed IEC. Chromatographia, no 74, 307-312, 2011.
ORES, J. C. Produção e extração da enzima anidrase carbônica e de ficobiliproteínas a partir de microalgas. 2014. 135 f. Tese (Doutorado em Engenharia e Ciências de Alimentos) - Universidade Federal do Rio Grande, Rio Grande, 2014.
ORES, J. C.; AMARANTE, M. C. A.; KALIL, S. J. Co-production of carbonic anhydrase and phycobiliproteins by Spirulina sp. and Synechococcus nidulans. Bioresource Technology, no 219, 219-227, 2016.
PATEL, A.; MISHRA, S.; PAWAR, R.; GHOSH, P. K.; Purification and characterization of C-Phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification, no 40, 248-255, 2005.
POCKER, Y.; STONE, J. The catalytic versatility of erythrocyte carbonic anhydrase. III. Kinetic studies of the enzyme-catalyzed hydrolysis of p-nitrophenyl acetate. Biochemistry, no 6, 668-678, 1967.
PURWANTO, M. G. M. The role and efficiency of ammonium sulfate precipitation in purification process of papain crude extract. Procedia Chemistry, no 18, 127-131, 2016.
RITO-PALOMARES, M.; NUNEZ, L.; AMADOR, D. Practical application of aqueous two- phase systems for the development of a prototype process for C-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology and Biotechnology, no 76, 1273-1280, 2001.
SALA, L. Extração simultânea de ficobiliproteínas e anidrase carbônica, e extração seletiva de C-ficocianina. 2017. 190 f. Tese (Doutorado em Engenharia e Ciência de Alimentos) – Universidade Federal do Rio Grande, Rio Grande – 2017.
SANTIAGO-SANTOS, M. C.; PONCE-NOYOLA, T.; OLIVEIRA-RAMÍREZ, R.; ORTEGA-LÓPEZ, J.; CAÑIZARES-VILLANUEVA, R. O. Extraction and purification of Phycocianyn from Calotrix sp. Process Biochemistry, no 39, 2047-2052, 2004.
SHEKH, A. Y.; KRISHNAMURTHI, K.; MUDLIAR, S. N.; YADAV, R. R.; FULKE, A. B.; DEVI, S. S.; CHAKRABARTI, T. Recent advancements in carbonic anhydrase – Drivem processes for CO2 sequestration: Minireview. Critical Reviews in Environmental Science and Technology, no 42, 1419-1440, 2012.
SILVA, L. A.; KUHN, K. R.; MORAES, C. C.; BURKERT, C. A. V.; KALIL, S. J. Experimental design as a tool for optimization of C-phycocyanin purification by precipitation from Spirulina platensis. Journal of the Brazilian Chemical Society, no 20, 5-12, 2009.
SONANI, R.R.; RASTOGI, R. P.; PATEL, R.; MADAMWAR, D. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry, no 7, 100-109, 2016.
SONI, B.; KALAWADIA, B.; TRIVEDI, U.; MADAMWAR, D. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata – isolated from the rocky shores of Bet Dwarka, Gurajat, India. Process Biochemistry, no 41, 2017-2023, 2006.
VINOBA, M.; BHAGIYALAKSHMI, M.; JEONG, S. K.; YOONA, Y. I. NAMA, S. C. Carbonic anhydrase conjugated to nanosilver immobilized onto mesoporous SBA – 15 for sequestration of CO2. Journal of Molecular Catalysis B: Enzymatic, no 75, 60-67, 2012.
YAN, S. G.; ZHU, L. P.; SU, H. N.; ZHANG, X. Y.; CHEN, X. L.; ZHOU, B. C.; ZHANG, Y. Z. Single-step chromatography for simultaneous purification of C-phycocyanin and allophycocyanin with high purity and recovery from Spirulina (Arthrospira) platensis. Journal of Applied Phycology, no 23, 1-6, 2011.
ZARROUK, C. Contribution a l’etude d’une cianophycee: Influence de divers facteurs physiques et chimiques sur la croissance et la photosynthese de Spirulina maxima. 1966. Faculte des Sciences, Universite de Paris 1966.
































