Avaliação de catalisadores de nióbio na reação de desidratação de n-butanol
ISBN 978-85-85905-21-7
Área
Físico-Química
Autores
Munari Steffens, C. (UFRGS) ; Schopf Pegoraro, G. (UFSM) ; Paula Gonçalves Salau, N. (UFSM) ; Barbosa Coutinho, E. (UFRGS) ; Schwaab, M. (UFRGS)
Resumo
Para a desidratação de n-butanol empregando-se óxido e fosfato de nióbio calcinados em diferentes temperaturas como catalisadores, foi avaliada a atividade e a seletividade nesta reação através de um planejamento experimental, variando-se temperatura de reação, massa de catalisador e vazão de butanol. Análises de DRX confirmaram a estrutura cristalina dos materiais. O aumento na temperatura de calcinação causou uma diminuição na conversão da reação de desidratação. Maiores conversões foram obtidas com os fosfatos como catalisadores, indicando uma maior acidez destes materiais. A vazão de butanol mostrou-se ser a variável com maior influência na reação. As reações de isomerização foram também observadas para ambos catalisadores, comprovando suas altas forças ácidas.
Palavras chaves
Desidratação; Butanol; Nióbio
Introdução
Olefinas leves são compostos extremamente importantes com muitas aplicações. Dentre elas, os isômeros de butenos podem ser empregados como aditivos ou monômeros na produção de polímeros, na fabricação, por exemplo, de materiais plásticos, borracha sintética e do composto éter metil-terc-butílico, que, por sua vez, é adicionado à gasolina a fim de tornar sua combustão mais limpa. Além disso, podem ser oligomerizados, formando produtos de maior peso molecular (GUNST et al., 2017; MARTÍN e GROSSMANN, 2014; ZHANG et al., 2010). Nos dias atuais, devido ao rápido esgotamento das fontes fósseis e a preocupação com a sustentabilidade, a produção de olefinas oriundas de fontes renováveis denominadas por “olefinas verdes”, tem se tornado cada vez mais importante no cenário industrial. A empresa Braskem já vem produzindo há alguns anos o “eteno verde”, o qual é produzido a partir da desidratação catalítica do etanol que, por sua vez, é obtido principalmente a partir da fermentação da cana-de-açúcar (JUNIOR, 2011). Assim como o eteno, isômeros de butenos podem ser produzidos através de fontes renováveis, como o butanol, o qual pode ser obtido através da fermentação de biomassa, ou ainda, a partir do etanol, por meio de uma reação catalítica heterogênea (NDABA et al., 2015). Desta forma, a produção de olefinas oriundas de biomassa tem como principal vantagem contribuir para a diminuição da emissão de gases causadores do efeito estufa, de forma que o dióxido de carbono da atmosfera é fixado nas plantas na forma de celulose ou hermicelulose, podendo, assim, ser convertido em biocombustíveis e, posteriormente em olefinas (HUBER et al., 2006). Quando estas últimas são utilizadas na produção de polímeros, promove-se a fixação do CO2 atmosférico por um longo período de tempo. A reação catalítica de desidratação de n-butanol para a produção de butenos se baseia no mecanismo que envolve a perda de uma molécula de água com o surgimento de uma ligação dupla entre dois átomos de carbono. Esta reação pode ocorrer em catalisadores heterogêneos com sítios ácidos em temperaturas moderadas, na faixa de 200 a 300°C, sendo 1-buteno o produto primário da desidratação de n-butanol (ZHANG et al., 2010). Quando o catalisador possui sítios com acidez elevada e/ou em temperaturas mais altas, ocorre a isomerização do 1-buteno, podendo formar 2-buteno e iso-buteno (KHAN et al., 2015; MACHO et al., 2001; ZHANG et al., 2010). Dentre os catalisadores mais utilizados nesta reação estão as zeólitas e aluminas (GUNST et al., 2017; JOHN et al., 2015; KHAN et al., 2015). Outra opção são os catalisadores de nióbio, óxido de nióbio hidratado (Nb2O5.nH2O) e fosfato de nióbio (NbOPO4), os quais apresentam características importantes para esta reação, porém são pouco utilizados (LIZUKA et al., 1983). Estes catalisadores são conhecidos por sua elevada acidez, em parte decorrentes da presença de hidroxilas na superfície do sólido (TANABE, 2003). O aumento da temperatura de calcinação do óxido de nióbio leva a perda de hidroxilas superficiais e consequente diminuição da acidez. Quando este material é submetido a temperaturas de calcinação maiores que 500°C, sua estrutura torna-se cristalina, com grande diminuição de suas propriedades ácidas e da área específica, levando a uma perda acentuada de sua atividade catalítica (CHAI et al., 2007; LIZUKA et al., 1983; OKAZAKI e KUROSAKI, 1990; PAULIS et al., 1999; TANABE, 1987). De maneira a solucionar esta desvantagem, o tratamento do óxido de nióbio com diferentes ácidos como ácido fluorídrico, ácido sulfúrico e ácido fosfórico vem sendo estudado. Destes, o uso de H3PO4 se mostra o mais eficiente, já que mantém uma elevada área específica com grande quantidade de sítios ácidos e, ainda, previne-se a cristalização destes materiais mesmo quando calcinados em temperaturas superiores a 600°C (OKAZAKI et al., 1987). Alguns autores observaram que a cristalização destes materiais ocorre somente a partir de 800°C (MARTINS et al., 1989; OKAZAKI et al., 1987). Ainda é importante ressaltar que este tratamento do óxido de nióbio com ácido fosfórico aumenta significativamente a força ácida do catalisador (NOWAK e ZIOLEK, 1999). Assim, neste trabalho serão avaliados os catalisadores de nióbio, Nb2O5.nH2O e NbOPO4, na reação de desidratação de n-butanol, para a produção de butenos. Em particular, será avaliado o efeito das condições do tratamento térmico (calcinação) nas propriedades dos catalisadores, assim como, na reação de desidratação de n- butanol. Nestas reações, para cada catalisador avaliado, foram usados diferentes valores de massa de catalisador, de temperatura de reação e de vazão de butanol e nitrogênio na alimentação.
Material e métodos
As amostras de óxido de nióbio hidratado, Nb2O5.nH2O (NbO), e fosfato de nióbio, NbOPO4 (NbP), foram fornecidas pela Companhia Brasileira de Metalurgia e Mineração (CBMM). O tratamento térmico das amostras foi realizado sob diferentes condições de calcinação, as quais foram escolhidas de acordo com o planejamento experimental, onde foi investigada a influência da temperatura de calcinação e do tempo de permanência na temperatura final. As amostras foram calcinadas em mufla com controlador de temperatura, consistindo no aquecimento das amostras da temperatura ambiente até a temperatura final a uma taxa de 10°C/min. A temperatura final variou entre 200 e 600°C para óxido de nióbio e entre 250 e 850°C para fosfato de nióbio, enquanto que o tempo de permanência das amostras na temperatura final variou entre 1 e 16 horas, conforme o plano experimental da calcinação. A análise de Difração de Raios-X (DRX) foi realizada em um difratômetro Philips-X'Pert MPD equipado com monocromador curvado de grafite e ânodo fixo de cobre, operando a 40 kV e 40 mA e radiação CuKα (1,54184 Å). As condições estabelecidas para as análises foram: varredura com passo angular de 0,05° com tempo de 1 segundo e intervalo entre 10° e 80°. A reação de desidratação catalítica de n-butanol foi realizada em um reator de quartzo com formato de “U” em um forno (Sanchis) com controle de temperatura (NOVUS). O leito fixo de catalisador consistiu de 100 a 300 mg de óxido de nióbio calcinado nas temperaturas de 200, 300, 400 e 500°C, por 4 horas e de 20 a 40 mg de fosfato de nióbio calcinado nas temperaturas de 250, 400, 550 e 700°C por 4 horas, conforme planejamento experimental. Butanol líquido (Neon) foi alimentado através de uma bomba de HPLC (Shimadzu, LC-20AT) com vazão volumétrica de 0,01 a 0,05 mL/min. Nitrogênio foi alimentado para a diluição da alimentação, sendo sua vazão volumétrica controlada (Mass-flow Controller, MKS) e ajustada em cada experimento de forma a manter a vazão volumétrica total constante em 47,55 mL/min a 200°C em todos os experimentos. Assim, a variação da vazão de butanol está diretamente ligada com a variação da concentração de butanol na alimentação, sem acarretar mudança no tempo espacial. Além disso, foram realizadas as reações nas temperaturas de 250, 275 e 300°C. A temperatura da linha de alimentação foi mantida em 160°C, para garantir a completa vaporização do butanol na alimentação e a temperatura da linha de saída foi mantida em 200°C, para evitar a condensação dos produtos da reação. As análises da corrente de saída do reator foram feitas por cromatografia gasosa (Shimadzu, GC-2014) com detector de ionização em chama (FID), usando uma coluna capilar GS-Carbonplot (Agilent Technologies) com 30 m de comprimento e diâmetro interno de 0,32 mm.
Resultado e discussão
Na Figura 1, são apresentados os difratogramas de raios-X para as amostras
calcinadas por 4 horas dos catalisadores NbO e NbP em diferentes
temperaturas, já que o tempo de permanência na temperatura final de
calcinação não mostrou efeito significativo sobre a estrutura das amostras.
Para as amostras de NbO, as que foram calcinadas até 400°C apresentaram
estrutura amorfa, estando de acordo com os perfis de difração encontrados na
literatura (LIZUKA et al., 1983; OHUCHI et al., 2007; PAULIS
et al., 1999).
Já o difratograma da amostra calcinada a 500°C apresenta característica de
material cristalino, o que está de acordo com resultados de Paulis et
al. (1999) e Ohuchi et al. (2007), porém é diferente daquele
encontrado por Lizuka et al. (1983). Deve-se observar que o trabalho
de Lizuka et al. (1983) não deixa claro as condições em que foram
feitos estes experimentos, como tempo e atmosfera de calcinação. Os picos
observados na amostra calcinada a 600°C e que não estão presentes na amostra
de 500°C, marcados por círculos na Figura 1, indicam um avanço no aumento da
cristalinidade do material.
Para as amostras de NbP, perfis de difração amorfo foram observados para
todas as amostras, exceto para a calcinada a 850°C, o que está de acordo com
os trabalhos reportados na literatura (CRUZ et al., 2006; MARTINS
et al., 1989; PEREIRA et al., 2004; SUN et al., 2006).
Entretanto, a amostra calcinada em 850°C apresentou difratograma de material
cristalino, o que já era esperado, visto que os catalisadores de fosfato de
nióbio tornam-se cristalinos em temperaturas superiores a 800°C (NOWAK e
ZIOLEK, 1999).
Como o tempo de calcinação não teve influência na estrutura dos
catalisadores, para a avaliação destes na reação de desidratação de butanol
só foram empregadas as amostras calcinadas por 4 horas. Os produtos
principais, para todos os catalisadores, foram 1-buteno e 2-buteno. O iso-
buteno foi obtido em quantidades próximas a 1% de seletividade e somente em
algumas condições de reação, indicando que a temperatura e/ou o tempo
espacial eram muito baixos, ou ainda, que os catalisadores não tinham sítios
com força ácida suficiente para promover esta isomerização. Por exemplo,
Zhang et al. (2010) observou uma formação significativa de iso-buteno
utilizando zeólita Theta-1, somente em temperaturas a partir de 400°C.
A tabela da Figura 1 apresenta o plano experimental utilizado para as
reações, sendo especificada a massa dos catalisadores óxido e fosfato de
nióbio, vazão de butanol e de N2. Réplicas foram realizadas na
condição central, a fim de se avaliar a incerteza experimental.
O efeito da temperatura final de calcinação no desempenho dos catalisadores
NbO sobre a conversão de butanol pode ser analisado através do gráfico na
Figura 2A, o qual corresponde a condição de reação 3. Pode-se observar
claramente que quanto menor a temperatura de calcinação, maiores são as
conversões obtidas. Entretanto, na temperatura de reação de 250°C, o
catalisador calcinado em 200°C apresentou conversão inferior quando
comparado aos catalisadores calcinados em 300 e 400°C. Isto pode ser devido
a flutuações experimentais, ou ao fato de que o catalisador foi calcinado a
uma temperatura inferior à de reação, podendo então, estar sofrendo uma
calcinação in situ. Desta forma, o catalisador com melhor desempenho
foi àquele calcinado na temperatura de 200°C, estando de acordo com os
resultados encontrados por Lizuka et al (1983), os quais apresentaram
maiores conversões em menores temperaturas de calcinação. Tal comportamento
é explicado pela diminuição dos sítios ácidos de Brønsted, indispensável
para a reação de desidratação de n-butanol, com o aumento da temperatura de
calcinação do óxido de nióbio. O catalisador calcinado em 500°C obteve
conversões muito baixas, visto que, nesta temperatura, o óxido de nióbio tem
estrutura cristalina, fase que não é ativa na reação (NOWAK e ZIOLEK, 1999).
Já para os catalisadores NbP, o gráfico da Figura 2C apresenta o efeito da
temperatura de calcinação na conversão da reação, também na condição de
reação 3. Observa-se o mesmo comportamento de diminuição da conversão com o
aumento da temperatura de calcinação, como observado para o NbO. Entretanto,
observa-se que a diferença entre os catalisadores calcinados nas
temperaturas de 250 e 400°C não é significativa. Mesmo o catalisador
calcinado em 550ºC apresenta apenas uma pequena diminuição na atividade
catalítica. Este resultado indica que o tratamento do catalisador com ácido
fosfórico, além de aumentar a temperatura de mudança de fase, mantém a
atividade catalítica mesmo quando o catalisador é calcinado em temperaturas
mais altas em comparação com o NbO, o que permite a utilização deste
catalisador em reações que necessitem de temperaturas mais elevadas. Já o
catalisador calcinado em 700°C apresenta uma queda mais acentuada na
conversão, pois apesar de ainda não ter acontecido a efetiva cristalização
do material, como observado pela análise de difração de raios-X, grande
parte da água presente em sua superfície já deve ter sido perdida.
O gráfico da Figura 2B apresenta as conversões obtidas em todas as condições
de reação para o catalisador NbO calcinado em 400°C. Observa-se que a melhor
condição de reação foi a 2, em que a massa de catalisador era máxima e a
vazão de butanol era mínima, alcançando 33% de conversão em 250°C e 100% já
em 275°C. A ordem decrescente de conversão obtidas nas reações foi: 2 > 4 >
Réplicas > 1 > 3. As condições 2 e 4 foram realizadas com a menor vazão de
butanol e as condições 1 e 3 com a maior vazão. Assim, o efeito principal,
na faixa experimental estudada, foi a vazão de butanol e o aumento da vazão
de butanol, leva a um aumento da concentração de butanol na alimentação,
provocando uma diminuição da conversão da reação. Esse comportamento
aparentemente desfavorável indica que a ordem aparente da reação é negativa,
isto é, os termos de adsorção em um mecanismo do tipo Langmuir-Hinshelwood-
Hougen-Watson tem grande importância. Outro ponto a ser observado é que o
efeito da variável massa de catalisador foi maior entre as condições 2 e 4,
em relação às condições 1 e 3, indicando que existe uma certa correlação
entre as variáveis.
O gráfico da Figura 2D apresenta as conversões obtidas em todas as condições
de reação, para o catalisador NbP calcinado em 550°C. A ordem decrescente
das condições de reação em relação às conversões, observada para o óxido de
nióbio, é novamente observada para o fosfato de nióbio. É importante
ressaltar que os comportamentos observados nos gráficos da Figura 2 também
foram observados nas demais condições de reação e de calcinação dos
catalisadores.
Ao serem comparados os gráficos A e C da Figura 2, respectivamente para o
NbO e NbP, pôde-se perceber que ambos atingem conversões similares. No
entanto, a massa de fosfato de nióbio utilizada é muito menor, isto é, 5
vezes menor, demonstrando que o caráter ácido, assim como, a atividade deste
catalisador nesta reação é maior quando comparado ao óxido de nióbio.
Para ambos os catalisadores, exceto para o NbO calcinado em 500°C, foi
observada uma significativa isomerização do 1-buteno a 2-buteno,
principalmente nas condições de reação 2 e 4, pois estas apresentam uma
maior conversão de n-butanol. A maior isomerização observada, para os
catalisadores NbO calcinados nas temperaturas de 200 e 300°C, foi alcançada
pela condição 4, em que a seletividade do 2-buteno chegou ao máximo de
aproximadamente 82%. O catalisador calcinado em 400°C alcançou essa maior
isomerização na condição 2 de reação. Já para o NbP, isto ocorreu na
condição 2 de reação, onde a seletividade do 2-buteno variou entre 74 e 79%,
aproximadamente, para os catalisadores calcinados em diferentes
temperaturas.
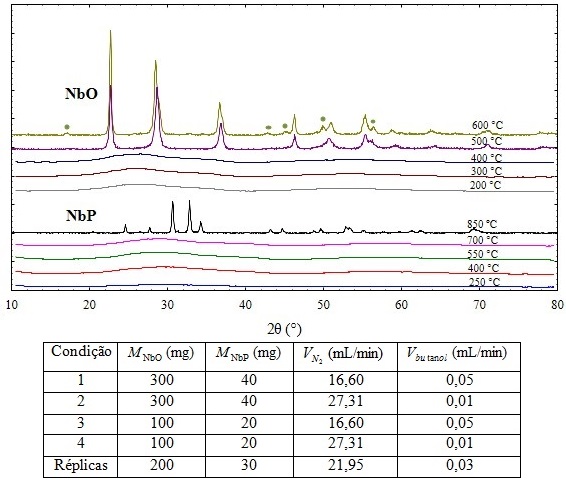
Figura 1 mostra o gráfico dos perfis de difração do NbO e NbP calcinados em diferentes temperaturas, além da Tabela com as condições de reação.
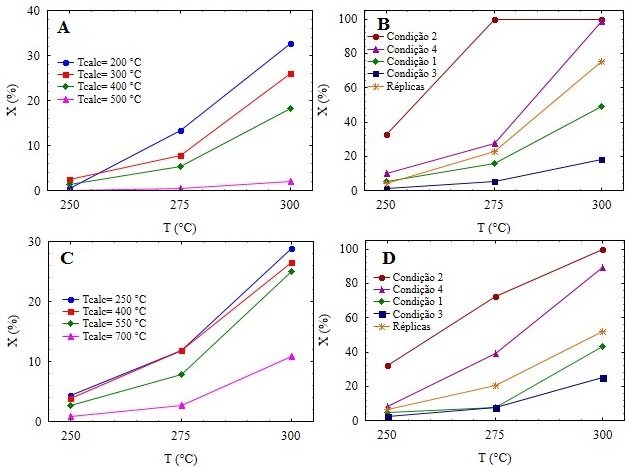
Conversão versus temperatura de reação para NbO e NbP em diferentes temperaturas de calcinação (A) e (C), e condições reacionais (B) e (D).
Conclusões
Catalisadores de nióbio, óxido e fosfato, foram avaliados na reação de desidratação de n-butanol, para a produção de butenos. Foi analisado o efeito das condições de calcinação nas propriedades cristalinas dos catalisadores, assim como, na reação de desidratação de n-butanol. As análises de difração de raios-X demonstraram que o tempo de calcinação não teve efeito significativo na estrutura de ambos catalisadores. A temperatura não apresentou efeito significativo sobre a estrutura cristalina das amostras calcinadas em temperaturas mais baixas. Entretanto, em 550°C para o óxido de nióbio e em 850°C para o fosfato de nióbio ocorre uma grande mudança na estrutura, onde o material amorfo passa a ter uma estrutura cristalina. Já no desempenho nas reações de desidratação de n-butanol, o aumento da temperatura de calcinação tem um efeito negativo na conversão, indicando que mesmo sem ocorrer uma mudança na estrutura do material, ocorre uma diminuição na atividade catalítica, devido provavelmente à diminuição da área específica e dos sítios ativos do catalisador. Esta diminuição das conversões é menos acentuada nos catalisadores NbP, já que estes têm a capacidade de manter a força ácida e a área específica, mesmo quando calcinados em temperaturas superiores a 500°C. As condições de reação com menores vazões de butanol alcançaram maiores valores de conversão quando comparadas com as outras condições, indicando que o aumento da concentração de butanol na alimentação leva a uma queda na taxa de reação, o que indica que a ordem de reação aparente é negativa. Ambos catalisadores apresentam ótimas condições para serem empregados na reação de desidratação de n-butanol, visto que, alcançam 100% de conversão em algumas condições de reação com uma significativa isomerização do 1- buteno a 2-buteno. No entanto, o fosfato de nióbio tem uma atividade catalítica muito maior, visto que alcança conversões similares ao óxido de nióbio com uma massa 5 vezes menor.
Agradecimentos
À CAPES e ao CNPQ pelas bolsas concedidas.
Referências
BUSCA, G. Acid Catalysts in Industrial Hydrocarbon Chemistry. Chemical Reviews, n° 107, 5366-5410, 2007.
CHAGAS, W. F.; BORGES, L. E. P.; BORGES, C. P. Alquilação de Isobutano com 1-Buteno em Reator Assistido por Membranas. Revista Militar de Ciência e Tecnologia, n° 31, 2014.
CHAI, S.; WANG, H.; LIANG, Y.; XU, B. Sustainable Production of Acrolein: Gas-phase Dehydration of Glycerol over Nb2O5 Catalyst. Journal of Catalysis, n° 250, 342-349, 2007.
CRUZ, M. H. C.; SILVA, J. F. C.; LACHTER, E. R. Catalytic Activity of Niobium Phosphate in the Friedel–Crafts Reaction of Anisole with Alcohols. Catalysis Today, n° 118, 379-384, 2006.
GUNST, D.; ALEXOPOULOS, K.; BORGHT, K. V. D.; JOHN, M.; GALVITA, V.; REYNIERS, M.; VERBERCKMOES, A. Study of Butanol Conversion to Butenes over H-ZSM-5: Effect of Chemical Structure on Activity, Selectivity and Reaction Pathways. Applied Catalysis A: General, n° 539, 1-12, 2017.
HUBER, G. W.; IBORRA, S.; CORMA, A. Synthesis of Transportation Fuels from Biomass: Chemistry. Chemical Reviews, n° 106, 4044 4098, 2006.
JOHN, M.; ALEXOPOULOS, K.; REYNIERS, M.; MARIN, G. B. Reaction Path Analysis for 1-Butanol Dehydration in H-ZSM-5 Zeolite: Ab Initio and Microkinetic Modeling. Journal of Catalysis, n° 330, 28-45, 2015.
JUNIOR, S. V. Biorrefinarias: Cenários e Perspectivas. Embrapa Agroenergia, n° 1, 2011.
KHAN, Y.; MARIN, M.; KARINEN, R., LEHTONEN, J.; KANERVO, J. 1-Butanol Dehydration in Microchannel Reactor: Kinetics and Reactor Modeling. Chemical Engineering Science, n° 137, 740-751, 2015.
LIZUKA, T.; OGASAWARA, K.; TANABE, K. Acidic and Catalytic Properties of Niobium Pentaoxide. Bulletin of the Chemical Society of Japan, n° 56, 2927-2931, 1983.
MACHO, V.; KRÁLIK, M.; JURECEKOVA, E.; HUDEC, J.; JURECEK, L. Dehydration of C4 Alkanols Conjugated with a Positional and Skeletal Isomerisation of the Formed C4 Alkenes. Applied Catalysis A: General, n° 214, 251-257, 2001.
MARTÍN, M.; GROSSMANN, I. E. Optimal Simultaneous Production of i-Butene and Ethanol from Switchgrass. Biomass and Bioenergy, n° 61, 93-103, 2014.
MARTINS, R. L.; SCHITINE, W. J.; CASTRO, F. R. Texture, Surface Acidic and Catalytic Properties of Niobium Phosphate. Catalysis Today, n° 5, 483-491, 1989.
NDABA, B.; CHIYANZU, I.; MARX, S. n-Butanol Derived from Biochemical and Chemical Routes: A Review. Biotechnology Reports, n° 8, 1-9, 2015.
NOWAK, I.; ZIOLEK, M. Niobium Compounds: Preparation, Characterization, and Application in Heterogeneous Catalysis. Chemical Reviews, n° 99, 3603-3624, 1999.
OHUCHI, T.; MIYATAKE, T.; HITOMI, Y.; TANAKA, T. Liquid Phase Photooxidation of Alcohol over Niobium Oxide without Solvents. Catalysis Today, n° 120, 233-239, 2007.
OKAZAKI, S.; KURIMATA, M.; LIZUKA, T.; TANABE, K. The Effect of Phosphoric Acid Treatment on the Catalytic Property of Niobic Acid. Bulletin of the Chemical Society of Japan, n° 60, 37-41, 1987.
OKAZAKI, S.; KUROSAKI, A. Acidic Properties and Catalytic Activities of Niobic Acid Treated with Phosphoric Acid. Catalysis Today, n° 8, 113-122, 1990.
PAULIS, M.; MARTÍN, M.; SORIA, D. B.; DÍAZ, A.; ODRIOZOLA, J. A.; MONTES, M. Preparation and Characterization of Niobium Oxide for the Catalytic Aldol Condensation of Acetone. Applied Catalysis A: General, n° 180, 411-420, 1999.
PEREIRA, C. C. M.; LACHTER, E. R. Alkylation of Toluene and Anisole with 1-Octen-3-ol
over Niobium Catalysts. Applied Catalysis A: General, n° 266, 67-72, 2004.
SUN, Q.; AUROUX, A.; SHEN, J. Surface Acidity of Niobium Phosphate and Steam Reforming of Dimethoxymethane over CuZnO/Al2O3–NbP Complex Catalysts. Journal of Catalysis, n° 244, 1-9, 2006.
TANABE, K. Catalytic Application of Niobium Compounds. Catalysis Today, n° 78, 65-77, 2003.
TANABE, K. Niobic Acid as an Unusual Acidic Solid Material. Materials Chemistry and Physics, n° 17, 217-225, 1987.
ZHANG, D.; AL-HAJRI, R.; BARRI, S. A. I.; CHADWICK, D. One-step Dehydration and Isomerisation of n-Butanol to Iso-butene over Zeolite Catalysts. Chemical Communications, n° 46, 4088-4090, 2010.
































