ANÁLISE DA CINÉTICA DE DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO (H2O2) NA PRESENÇA DE UM CATALISADOR
ISBN 978-85-85905-21-7
Área
Físico-Química
Autores
Pojo, R.R.C. (UFPA) ; Cordeiro, N.M. (UFPA) ; Pinho, T.F.V. (UFPA) ; Elias, B.A. (UFPA) ; Gonçalves, L.R. (UFPA) ; Cardoso Filho, J.C.A. (UFPA) ; Soeiro, W.F. (UFPA)
Resumo
O peróxido de hidrogênio é um composto instável, de rápida decomposição, com diversas aplicações, desde domésticas a industriais. Por conseguinte, o estudo da sua cinética de decomposição faz-se necessário. No presente estudo, a análise da cinética dessa reação se deu com base na variação da quantidade de oxigênio produzido na reação, em função do tempo, medida por meio de um manômetro de coluna líquida na presença do Iodeto de Potássio como catalisador. O experimento foi realizado em duplicata e os valores de altura monométricas permitiram os cálculos para o volume de oxigênio e posterior análise gráfica da cinética resultando em uma reação de primeira ordem com constante de velocidade k=0,0001s-1 e coeficiente de determinação R²=0,9998.
Palavras chaves
Decomposição; Velocidade; Ordem
Introdução
O peróxido de hidrogênio é um composto inorgânico molecular de fórmula química H2O2. Trata-se de um líquido incolor à temperatura ambiente, poderoso oxidante, solúvel em água e viscoso. Em solução aquosa, é conhecido comercialmente como água oxigenada, que pode ser produzida a partir da reação de qualquer peróxido com água ou ácidos diluídos.O peróxido de hidrogênio possui diversas aplicações em várias áreas, dentre as quais estão a agricultura, plastificantes, sabões e detergentes, têxtil e outras¹. As ligações entre as moléculas de peróxido de hidrogênio são fracas e, por este motivo, a substância é bastante instável. Quando perturbada, decompõe- se rapidamente em água (H2O) e oxigênio (O2). A reação de decomposição do peróxido de hidrogênio em solução aquosa libera um mol de peróxido decomposto para cada meio mol de oxigênio gasoso produzido². Esta reação, ocorrendo de forma natural, em temperatura ambiente, é considerada lenta, sendo necessário um catalisador para que ela ocorra de forma mais rápida. Um catalisador é uma substância capaz de acelerar a velocidade em que se processam determinadas reações químicas, diminuindo sua energia de ativação, sem sofrer alterações, ou seja, não é consumido, mas regenera-se completamente no final³. Assim, dependendo do meio e das substâncias envolvidas, a decomposição do peróxido pode ocorrer em diferentes velocidades. Este estudo, portanto, centra-se na análise da cinética de decomposição do peróxido de hidrogênio na presença de Iodeto de Potássio (KI) como catalisador.
Material e métodos
Para a análise preparou-se uma solução 10% de Peróxido (Peróxido de Hidrgênio P.A- Vetec Química Fina, Solução Aquosa classe 5.1), diluindo-se 70 ml do reagente em 500 ml de água destilada, armazenada em um balão volumétrico fechado. No inicio do experimento retirou-se uma alíquota de 180 ml em um balão volumétrico de 250 ml com válvula, onde foram adicionadas 10 gotas do Iodeto de Potássio (0,1 mol/L), que funcionou como catalisador. O balão com a válvula fechada, então foi acoplado a um tubo e este a um manômetro. Neste caso, o fluido manométrico utilizado foi a água, ideal para baixas pressões. A partir do momento em que a reação catalisada iniciar, espera-se que o oxigênio gasoso produzido, seja conduzido pelo tubo e provoque alteração na altura do fluido manométrico. É medido, por conseguinte, a variação desta altura no intervalo de 1cm e da pressão parcial do oxigênio em função do tempo. As medições foram feitas em duplicata. Deve-se salientar que possíveis fontes de erro foram minimizadas a partir do controle de variáveis experimentais, tais quais: a junção entre o balão volumétrico reacional e o tubo de condução do gás foi impermeabilizada com graxa de silicone para evitar vazamentos de oxigênio; o controle da temperatura ambiente foi previamente feito para evitar mudanças bruscas, o que acarretaria na variação da propriedade da efusão (grau de agitação das moléculas), ocasionando erros de medição.
Resultado e discussão
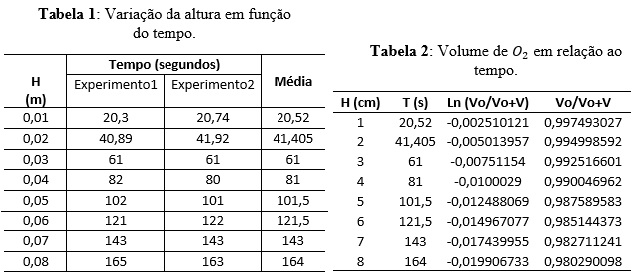
Decorrida a reação, obtiveram-se as seguintes variações de altura
manométrica em função do tempo descritas na tabela 1. O tempo usado para
análise foi obtido através da média aritmética entre os tempos para cada
experimento.
Para os cálculos do volume de O2, é usada a equação do volume do cilindro,
com base nas variações de altura (H) observadas no experimento. O diâmetro
medido do manômetro é definido em 4 milímetros.
Dessa forma, partindo-se do princípio que a reação apresenta comportamento
de 1ª ordem e sabendo que o volume inicial (Vo) no manômetro é de 50ml,
foram obtidos os dados da tabela 2.
Sendo o volume total (Vo+V) a soma entre o volume inicial (50 ml) e os
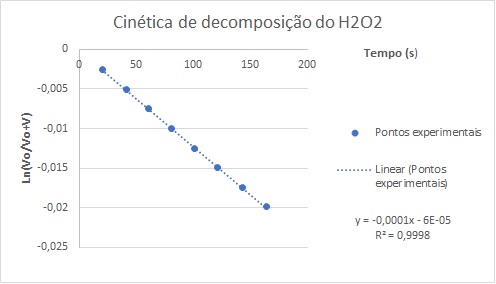
volumes obtidos experimentalmente. A partir desses dados, temos o gráfico 1,
obtendo a constante de velocidade K=0,0001.s-1.
Dessa maneira, é observado um comportamento linear na reação de
decomposição, com um coeficiente de determinação de R² = 0,9998. Isso
significa que 99,98% dos dados experimentais podem ser representados por
meio da equação encontrada e que fornece o valor da constante de velocidade
da reação, comprovando a relação de 1° ordem.
Conclusões
Assim, pode-se afirmar que o método de análise por meio da quantidade de oxigênio produzido mostrou-se eficaz para estudo da cinética de decomposição do peróxido dentro das condições estudadas. A análise experimental resultante comprovou o comportamento de primeira ordem da reação em questão, apresentando velocidade e coeficiente de determinação satisfatórios.
Agradecimentos
Referências
[1] Peróxido de hidrogênio, disponível em: <https://www.estudopratico.com.br/peroxido-de-hidrogenio-caracteristicas-aplicacoes-e-agua-oxigenada/> Acesso em 28 de julho de 2017.
[2] Godoi, S.G., Determinação de alguns parâmetros cinéticos da reação de decomposição do peróxido de hidrogênio, aula 13, disponível em: <http://www.cesadufs.com.br/ORBI/public/uploadCatala-go/11410816022012Cinetica_Quimica_Aula_13.pdf> Acesso em 28 de julho de 2017.
[3] Manual da química, disponível em: <http://manualdaquimica.uol.com.br/fisico-quimica/catalisador.htm> Acesso em 28 de julho de 2017.
































