CINÉTICA QUÍMICA DA REAÇÃO DE SAPONIFICAÇÃO DO ACETATO DE ETILA ATRAVÉS DE MEDIDAS DE pH
ISBN 978-85-85905-21-7
Área
Físico-Química
Autores
Batalha, K.C. (UNIVERSIDADE FEDERAL DO PARÁ) ; Silva, G.K.M. (UNIVERSIDADE FEDERAL DO PARÁ) ; Raiol, T.S. (UNIVERSIDADE FEDERAL DO PARÁ) ; Cardoso Filho, J.C.A. (UNIVERSIDADE FEDERAL DO PARÁ)
Resumo
O estudo realizado objetiva analisar o comportamento da reação entre o Acetato de Etila e o Hidróxido de Sódio em dois casos, para concentrações iguais e para o caso em que as concentrações são diferentes, na qual o primeiro reagente se encontra em uma concentração muito maior que o segundo, tomando como parâmetro para tal análise a variação de pH ao decorrer da reação. No primeiro caso a reação se comportou com 2° ordem, de acordo com a literatura, já no segundo caso a reação se apresentou como 1°ordem, sendo, portanto, uma reação de pseudo primeira ordem, o que evidencia a influência que a concentração dos reagentes possui no comportamento das reações químicas.
Palavras chaves
comportamento de reações; concentração de reagentes; pH
Introdução
O comportamento das reações químicas estão intimante ligados a fatores como concentração, temperatura, pH, meio reacional entre muitos outros, dependendo de cada reação. A concentração, obviamente, é um dos fatores que mais influenciam as reações, podendo mudar características e classificações de uma determinada reação, como, por exemplo, a sua ordem. O pH, potencial hidrogeniônico, é uma escala de 14 unidades que indica a acidez ou não de uma solução, quanto mais baixo, maior a concentração de íons H+, quanto mais alto, maior a concentração de OH-. Como é possível verificar através da relação pH = - log[H+], o pH está relacionado com a concentração de hidrogênios presentes em uma reação, e, portanto, à concentração do reagente estudado, o que pode ser usado para indicar o comportamento desta. A reação entre o Acetato de Etila e o Hidróxido de Sódio é classificada, na literatura, como uma reação de 2° ordem, que, no entanto, pode apresentar comportamento diferente frente à mudança de concentração entre os reagentes utilizados. O que nos fornece uma clara noção da influência que a mudança de concentração dos reagentes possui sobre a reação entre os mesmos.
Material e métodos
Inicialmente 100 mL de uma solução de hidróxido de sódio (NaOH) a 0,02 mol/L foi misturada a 100mL de uma solução de acetado de etila (C4H8O2) também a 0,02 mol/L que já estava em um erlenmeyer de 250mL junto ao pHmetro, à temperatura ambiente. O pH foi observado até a sua estabilização para marcar o tempo zero, e a partir desse momento, o tempo decorrido foi anotado para cada decaimento ocorrido no valor do pH. O mesmo procedimento foi realizado, usando as mesmas soluções e concentrações, porém volumes diferentes, 200 mL de acetato de etila e 20 mL de hidróxido de sódio.
Resultado e discussão
Foram plotados gráficos, dispostos na Figura 2 (o primeiro para
concentrações iguais, o segundo para concentrações diferentes) para cada
ordem de reação (zero, primeira e segunda ordem) de acordo com os modelos
gerais estabelecidos pela literatura, nos quais foram obtidos os resultados
dispostos na tabela da Figura 1.
De acordo com a literatura (Ref. 1), a ordem da reação de saponificação do
Acetato de Etila é de segunda ordem global, porém quando a concentração de
acetato é consideravelmente maior em relação à concentração de hidróxido de
sódio, no segundo experimento, a reação passa a ter comportamento de
primeira ordem, denominada pseudo primeira ordem. Portanto, os dados
experimentais obtidos estão de acordo com a teoria, com constante de
velocidade (k) igual a 1,08x102 L mol-1 s-1 para a reação de segunda ordem e
6,34x104 s-1 para a reação de primeira ordem.
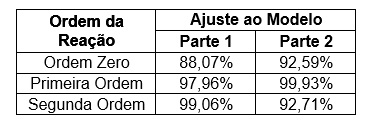
Tabela contendo os valores correspondentes ao parâmetro R2 para cada ordem.
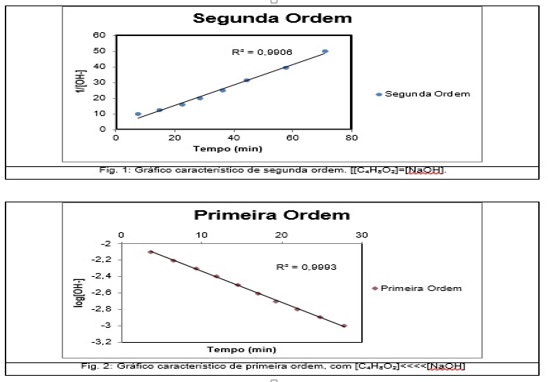
Gráfico 1, com concentrações iguais, Gráfico 2, com concentrações diferentes.
Conclusões
A velocidade da reação foi alterada quando a concentração de acetato de etila foi muito superior à de hidróxido de sódio. Como a reação é de 1:1, o NaOH reagiu apenas com a quantidade de C4H8O2 correspondente, fazendo com que a reação fosse mínima e quase sem efeito frente a grande quantidade de solução de acetato de etila ainda presente sem reagir, permitindo que a reação, sabidamente de segunda ordem, se comportasse como uma reação de primeira ordem. Isso nos permite provar, experimentalmente, a diferença que a concentração dos reagentes pode provocar na velocidade das reações.
Agradecimentos
Referências
1. ATKINS, P. W; PAULA, Julio de. Físico - Química. 8° ed. Rio de Janeiro: LTC, 2008. Volume 2.
































