Estudo da ressonância eletrônica das ligações químicas duplas alternadas por meio de modelos alternativos com embalagens de leites fermentados.
ISBN 978-85-85905-21-7
Área
Ensino de Química
Autores
Mascarenhas, M.S. (COLUNI/UFV) ; Mariano, K.A.S.M. (COLUNI/UFV) ; Monteiro, A.A. (COLUNI/UFV)
Resumo
A ressonância é o deslocamento ininterrupto dos elétrons das ligações π de uma molécula, sem modificar a posição dos átomos e, normalmente, ocorrem em compostos que possuem ligações duplas conjugadas, características de anéis aromáticos e outros compostos. O trabalho propôs um método lúdico alternativo como atividade experimental para o tema e utilizou-se embalagens de leite fermentado, simulando os orbitais atômicos. A partir desse material, foram construídas moléculas, explicitando o tipo de hibridação dos átomos de carbono e a forma de associação entre os mesmos na formação de compostos. Como resultado, obteve-se uma maneira mais pragmática de exemplificar o conteúdo abordado em sala de aula, sendo o material objeto de estudo no ensino médio do Colégio de Aplicação da COLUNI/UFV.
Palavras chaves
ressonância eletrônica; hibridação sp2; anel aromático
Introdução
Entre os maiores desafios enfrentados pelo sistema educacional, destaca-se a falta de disponibilidade de recursos tecnológicos nas escolas, principalmente quando se trata da escola pública brasileira. Desse modo, uma série de disciplinas, que necessitam de atividades experimentais para a devida absorção do conteúdo, revela-se de difícil assimilação por parte do aluno. Essa dificuldade na aprendizagem, resultante da indisponibilidade dos equipamentos exigidos para a compreensão, apresenta-se um dos motivos de desinteresse do estudante quanto à escola e da perpetuação do mito de que certas disciplinas, como a química, são de difícil entendimento. Foi com o objetivo de contornar essa defasagem na aprendizagem da química que foi desenvolvido o trabalho em questão, cuja ideia central é criar e aperfeiçoar métodos lúdicos alternativos para que o estudante compreenda o conteúdo de maneira satisfatória, como exemplo, a ressonância química. A ressonância é o deslocamento de elétrons sem que haja mudança na posição dos átomos na molécula (FONSECA, 2007) e normalmente, são usados vários termos como “híbridos de ressonância”, “ligações deslocalizadas”, “mesômeros” referentes a esse fenômeno (JÚNIOR et al., 2014). A ressonância química ou mesomeria foi proposta em 1930 por Linus Pauling e acontece em substâncias covalentes ou moleculares, como exemplo os anéis aromáticos (compostos que possuem ligações duplas e simples alternadas), compostos com duplas conjugadas como o buta-1,3-dieno (FELTRE, 2008), no grupo funcional dos ácidos carboxílicos na forma do híbrido de ressonância carboxilato e no grupo nitro dos nitrocompostos (BARBOSA, 2004 e JÚNIOR et al., 2014).
Material e métodos
Foi realizada uma campanha na escola para a coleta de embalagens vazias de leite fermentados do tipo Yakult, Chamyto e outras marcas envolvendo os alunos, funcionários e professores. Durante a campanha explicou-se os objetivos do projeto desenvolvido em questão e de que forma ele auxiliaria os alunos no processo de aprendizagem de química orgânica. As embalagens tiveram como proposta simular os orbitais híbridos e não híbridos nas ligações entre os átomos de carbono quando sofrem a ressonância. Os materiais usados para confecção dos modelos foram frascos de leite fermentado, bastão de cola quente de silicone, aplicador de cola quente, adesivo colorido (duas cores) para diferenciar os orbitais híbridos e não híbridos, bolinhas de isopor, fios de cobre, velcro e tesoura. A hibridação do carbono quando o composto químico sofre a ressonância é sp2, portanto, a geometria espacial é trigonal plana que possui, na camada de valência, três orbitais híbridos do tipo sp2 com ângulo de 120º entre si e um orbital p perpendicular aos orbitais híbridos. Cada um orbital possui um elétron desemparelhado podendo fazer a ligação com outros átomos. Para a montagem dos modelos, as embalagens (orbitais) foram unidas pelo fundo com cola quente para simular a ligação covalente, onde os orbitais sp2, representados por uma única embalagem, foram revestidos de papel adesivo vermelho e os orbitais p, representados por duas embalagens unidas pela parte superior (simulando a forma de um halter simétrico) na cor azul. As bolinhas de isopor simularam os átomos de hidrogênio e foram coladas sobre as mesmas um pedaço de velcro para serem unidas aos átomos de carbono, também com velcro na extremidade, na formação das moléculas. O fio de cobre foi usado para fazer a ligação entre os orbitais do tipo p.
Resultado e discussão
Foi escolhido o benzeno para a elaboração do modelo alternativo da ressonância.
O benzeno é formado por seis átomos de carbono, ligados entre si, formando um
anel sendo que cada carbono está ligado a um hidrogênio (FONSECA, 2007). As
ligações entre carbonos deveriam apresentar duplas e simples alternadas de
acordo com muitas representações químicas utilizadas. No entanto, essas
representações apesar, de evidenciar as ligações duplas e simples como é
demonstrado na Figura 1, métodos experimentais revelam que a ligação entre os
carbonos têm o mesmo comprimento (140 pm), ou seja, distância intermediária
entre uma ligação dupla (~134 pm) e a simples (~153 pm) (BARBOSA, 2004).
A representação da ressonância com as embalagens alternativas foi realizada
utilizando 5 embalagens de leite fermentado para cada átomo de carbono. A Figura
2 apresenta a disposição das embalagens para melhor compreensão. Três potinhos
foram revestidos com adesivo vermelho para representarem os orbitais sp2 e
unidos com cola no mesmo plano com a distância de 120º entre si, formando uma
estrutura trigonal plana. Em seguida 2 embalagens foram revestidas de azul que
juntas representam o orbital p e foram coladas perpendicularmente aos orbitais
sp2. Como o benzeno é formado por 6 átomos de carbono, o procedimento anterior
foi repetido por 6 vezes. Os carbonos sp2 foram unidos com cola representando a
ligação sigma formando o anel aromático. As embalagens que representam os
orbitais p foram furadas e fixadas os fios de cobre na representação da ligação
pi que ocorre quando esses orbitais estão paralelos. Observe que os fios podem
se mover, tanto para um lado como para o outro, simulando a ressonância que
ocorre entre os elétrons pi. O modelo elaborado também mostrou o mesmo tamanho
entre as ligações.
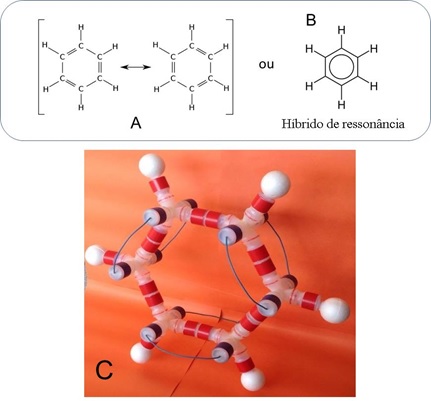
O benzeno. A: Fórmulas canônicas do benzeno. B: Representação do híbrido de ressonância. C: Modelo alternativo da fórmula estrutural do benzeno.
Procedimento de montagem do carbono com hibridação sp2.
Conclusões
Os estudos com o material alternativo facilitou a abordagem sobre a ressonância sendo uma maneira mais pragmática de exemplificar o conteúdo, além de ressaltar o caráter sustentável do material desenvolvido. Sob esse ângulo, é possível que, através da pesquisa desenvolvida com os materiais alternativos, o aluno seja capaz de participar de forma mais interativa das aulas e ainda desenvolver noções de sustentabilidade. Assim, o ensino a partir de instrumentos lúdicos, vinculado à responsabilidade socioambiental, evidencia o modo que ambas as preocupações podem ser saciadas em conjunto.
Agradecimentos
Agradecemos ao CNPq e à FAPEMIG pela concessão das bolsas científicas aos alunos do PIBIC-EM, a CAPES pelo apoio e aos alunos do Cap-COLUNI/UFV pela campanha das emba
Referências
BARBOSA, Luiz Cláudio de Almeida. Introdução à Química Orgânica- São Paulo: Ed. Pearson Prentice Hall, 2004.
FELTRE, Ricardo. Química Orgânica 3, 7ª edição – São Paulo: Ed. Moderna, 2008.
FONSECA, Martha Reis Marques da. Química Orgânica, São Paulo: Ed. FTD, 2007.
JÚNIOR, José Nunes da Silva, BARBOSA, Francisco Geraldo, JÚNIOR, Antonio José Melo Leite e EDUARDO, Valeska Mesquita. Ressonância: desenvolvimento, utilização e avaliação de um software educacional, Química Nova, v. 37, p. 373-376, 2014.
RAMOS, Joana Maria, IZOLANI, Antônio Orlando, TÉLLEZ, Cláudio Alberto, SANTOS, Maria Josefa Gomes. O Conceito de Hibridização. Química Nova Na Escola, v.1, p.28, 24-27, 2008.
































