OBSTÁCULOS EPISTEMOLÓGICOS NO ENSINO-APRENDIZAGEM DE FUNÇÕES INORGÂNICAS: uma investigação no ensino médio
ISBN 978-85-85905-21-7
Área
Ensino de Química
Autores
Ramos, R.A. (IFRJ) ; Messeder, J.C. (IFRJ) ; de Castro, D.L. (IFRJ)
Resumo
O presente trabalho investigou possíveis obstáculos epistemológicos existentes no conhecimento de funções inorgânicas de alunos do ensino médio em três redes diferentes de ensino. Baseado nos conceitos da epistemologia de Gaston Bachelard, este trabalho teve como objetivo demonstrar o equívoco causado pelo conceito das funções inorgânicas, quando confrontado com as teorias ácido-base de Arrhenius. Para coleta de dados foi desenvolvido um questionário para avaliar esses obstáculos de aprendizagem entre os estudantes. Os resultados indicaram que tais obstáculos são associados à forma como alguns conteúdos ainda são trazidos nos livros didáticos de química do ensino médio, e a necessidade de uma maior atenção por parte dos professores, que devem se ater à evolução do conhecimento cientifico.
Palavras chaves
obstáculo epistemológico; funções inorgânicas; teoria de Arrhenius
Introdução
No Brasil, ensinar química no ensino médio, ou transmitir um conhecimento químico para o aluno, tem se tornado uma tarefa muito árdua para o professor, a partir do momento que muitos aspectos da química, ensinados através de livros didáticos, têm sidos descontinuados e até mesmo desconstruídos ao longo do tempo. Diante desta problemática, o presente trabalho se baseou numa investigação sobre os equívocos causados no ensino- aprendizagem da teoria ácido-base de Arrhenius, principalmente, quando o tópico de funções Inorgânicas (ácidos, bases, sais e óxidos), deve ser apresentado para alunos do ensino médio. A teoria ácido-base de Arrhenius teve sua origem em 1887, quando o Químico sueco Svante August Arrhenius realizou experimentos que testavam a condutividade elétrica em solução, verificando que determinadas substâncias sofriam ionização (reagiam com a água e formavam íons) ou dissociação iônica (íons já existentes eram separados pela ação da água) e ainda conduziam a corrente elétrica. De modo geral, a Teoria da Dissociação Eletrolítica de Arrhenius explicou o fato que as propriedades de uma solução diluída de um eletrólito dependem da soma dos íons presentes na solução e a combinação que esses íons produzem ao invés das propriedades do próprio composto químico. Essa Teoria da Dissociação Eletrolítica lhe rendeu o prêmio Nobel de Química em 1903. Arrhenius não postulou uma definição para ácidos e bases, mostrou apenas que a reação de neutralização entre um ácido forte e uma base forte em solução aquosa é descrita pela equação (ARRHENIUS, 1904): H+ (aq) + HO- (aq) → HOH(l). Sendo essa a equação fundamental de neutralização e assumindo que H+ (mais comumente usado H3O+) corresponda a uma simplificação dos agregados catiônicos formados em soluções aquosas, pode-se definir ácido como uma espécie que, em solução aquosa, aumenta a concentração de H3O+, e base como uma espécie que, em solução aquosa, aumenta a concentração de OH- (KOTZ; TREICHEL JR., 2005). Partindo desse pressuposto podemos considerar que em solução aquosa teremos aumento de íons Hidrônio (H3O+) ou de Hidroxilas (OH-) de acordo com a adição de substâncias que contenham os íons em questão ou pelo fato que determinadas substâncias em solução aquosas removam íons H3O+ ou OH- do sistema, o que implica na reação dessas substâncias com a água ou com suas espécies dissociadas (DOUGLAS et al., 1994). De acordo com essa definição, podemos associá-la a definição de ácido-base de Arrhenius facilmente, porém não é isso que acontece, pois os alunos de ensino médio trazem uma definição equivocada oriunda dos livros didáticos (CAMPOS; SILVA, 1999), na qual ou se afirma que ácido é uma espécie que, em solução aquosa, libera (doa) o cátion H3O+, e base é uma espécie que, em solução aquosa, libera (doa) o ânion OH-. Observa-se que nesse caso, o entendimento do assunto, por esses alunos, pode ser resumido dessa forma: se a espécie em questão libera (ou doa) um determinado íon, só pode fazê-lo porque o íon em questão faz parte de sua composição, ou seja, de sua fórmula. Também observamos como a definição ácido-base de Arrhenius têm sido usada indevidamente, quando deparamos com o tópico funções inorgânicas (ácido, base, sal e óxido). Temos grande parte dos livros de química do ensino médio abordando o tema funções inorgânicas usando as definições de Arrhenius para ácidos e bases e definindo óxidos como compostos binários nos quais o oxigênio é o elemento mais eletronegativo e sais como produto de reações entre ácidos e bases. Distinguem-se ainda nas funções inorgânicas os sais e os óxidos ácidos, básicos, neutros e anfóteros (USBERCO, 2006). Observa-se que o problema em questão é como o assunto funções inorgânicas acabam se tornando um obstáculo para o ensino-aprendizagem do aluno, uma vez que tal tema reforça, e muito, que ele deva decorar tal conceito. Tal situação acaba tirando deste estudante o prazer pela ciência, uma vez que temos professores de química do ensino médio, preocupados com o cumprimento fiel do currículo mínimo, que colocam esse assunto em uma posição de destaque. Identificado tal obstáculo, é preciso um ajuste criterioso de como remodelar tal conteúdo para ser aplicado para alunos de ensino médio, de forma que tal conhecimento seja trabalhado com menos obstáculos no desenvolvimento do conteúdo, estimulando professores a romperem com “certas tradições” (MORTIMER, 1988). Tais obstáculos para a produção de conhecimento do aluno impedem o avanço do pensamento cientifico que, para Bachelard (2001), se trata de um “Obstáculo Epistemológico”. Esse trabalho teve como objetivo investigar os obstáculos epistemológicos no processo de ensino-aprendizagem da definição ácido-base de Arrhenius, que são diversamente obstruídos pelo tópico funções inorgânicas, para alunos de ensino médio em geral.
Material e métodos
A metodologia utilizada teve como base a pesquisa feita por Silva, et al. (2014), que investigaram estudantes de graduação do curso de Química Industrial e Licenciatura em Química da UFRRJ. Neste trabalho aqui apresentado, houve a necessidade de investigar os mesmos obstáculos epistemológicos de ensino-aprendizagem nas suas origens, isto é, com alunos de ensino médio que acabaram de ver o tópico funções inorgânicas, e também, observar como seriam as compreensões desses estudantes acerca da definição ácido-base de Arrhenius. Os sujeitos da pesquisa foram alunos de segundo e terceiro ano do ensino médio de escolas da rede pública estadual, rede pública técnica federal e também da rede privada técnica de ensino. Foi desenvolvido um questionário de quatro perguntas contendo a definição da teoria ácido-base de Arrhenius, como mostra a figura 1. Esse questionário foi respondido por 36 alunos da rede pública estadual, 40 alunos da rede pública técnica federal e 42 alunos da rede privada técnica de ensino, totalizando 118 alunos. Cada aluno das diferentes redes de ensino foi separado em grupos, a fim de detectar onde está a maior influência dos obstáculos epistemológicos entre eles. Sendo assim o Grupo 1 corresponde a alunos de segundo e terceiro anos do ensino médio da rede publica estadual, o Grupo 2 corresponde a alunos de segundo e terceiro anos do ensino médio da rede privada técnica de ensino e o Grupo 3 corresponde a alunos de segundo e terceiro anos do ensino médio da rede publica técnica federal. As duas primeiras perguntas foram objetivas e as respostas pretendidas eram sim ou não para a presença de hidrogênio em ácidos e hidroxila em bases. O objetivo dessa questão foi identificar obstáculos substancialistas entre os estudantes. Todos os participantes que responderam ao questionário receberam informações sobre o objetivo do estudo e o que seria feito com resultados da investigação. Também foi garantido o anonimato e assegurado o direito à recusa em participar da pesquisa.
Resultado e discussão
Nessa pesquisa, cada aluno das diferentes redes de ensino foram separados em
grupos, a fim de detectar onde está a maior influencia dos obstáculos
epistemológicos entre eles. Sendo assim o Grupo 1 corresponde a alunos de
segundo e terceiro anos do ensino médio da rede publica estadual, o Grupo 2
corresponde a alunos de segundo e terceiro anos do ensino médio da rede
privada técnica de ensino e o Grupo 3 corresponde a alunos de segundo e
terceiro anos do ensino médio da rede publica técnica federal.
As duas primeiras perguntas foram objetivas e as respostas pretendidas eram
sim ou não para a presença de hidrogênio em ácidos e hidroxila em bases. O
objetivo dessa questão foi identificar esses “obstáculos” entre os
estudantes.
Como pode perceber, há claramente um obstáculo epistemológico para esses
alunos, pois grande parte respondeu que sim, ou seja, para estes, uma
substância que reaja como um ácido de Arrhenius tem que ter hidrogênio (H)
em sua fórmula e uma base de Arrhenius tem que ter hidroxila (OH) em sua
fórmula. Essas afirmações estão erradas, pois segundo a definição de
Arrhenius, ela não especifica nada sobre a necessidade de ácidos terem
hidrogênio e bases terem hidroxila em suas composições como discutido
anteriormente.
Se compararmos os grupos veremos que o Grupo 3, têm mais estudantes com um
entendimento melhor do conceito. Por se tratar de escola técnica federal,
imagina-se que a compreensão desses conteúdos da química seja mais
aprofundada do que em escolas de ensino regular. Porém o resultado está
abaixo do esperado nos três grupos, evidenciando que esse erro frequente em
sala de aula é reflexo dos erros que também ocorrem em livros didáticos de
química para ensino médio. E se comparar a maior quantidade de respostas
“sim” para a primeira pergunta é de se esperar que a ideia de que o
hidrogênio deva fazer parte da própria substância, está “entranhado” na
cabeça do aluno, pelo enorme número de exemplos visto em livros didáticos, o
que causa muita confusão e o fato de haver uma diminuição de “sim” na
segunda resposta deve-se o fato desses alunos terem visto exemplos de
moléculas orgânicas como o ácido acético (CH3COOH) que mesmo tendo o OH em
sua formula, não pode ser chamada de base.
A terceira pergunta refere-se a um erro comum em salas de aula, dizer que
sal é o produto da neutralização de um ácido por uma base, mesmo se tratando
de reações em solução aquosa. É possível ver os alunos cometendo esse
equívoco e até mesmo sendo ensinado dessa forma pelos professores. Se formos
analisar a equação de neutralização desses reagentes de igual concentração
molar, vemos:
H+ (aq) + Cl- (aq) + Na+ (aq) + HO- (aq) -----------> Na+ (aq) + Cl- (aq) +
H2O (l)
Logo podemos cancelar os íons cloreto e sódio e concluir que o único produto
da neutralização de um ácido forte (HCl) por uma base forte (NaOH) é a água
como definiu o próprio Arrhenius (1904). Para obter o sal cloreto de sódio
(NaCl) devemos evaporar a solução para obter os cristais desse sal.
Nessa pergunta as respostas mais comuns foram dadas conforme figura no
final.
No gráfico, se somarmos as respostas que contém NaCl (54%) e NaCl + H2O
(40%) temos 94% das respostas com a repetição do erro em considerar o NaCl
como um produto da reação. A reprodução desse erro pode estar associada à
forma como é ensinado o balanço de massa das equações químicas que na
maioria das vezes desconsidera que eletrólitos fortes em solução tenderão a
permanecer em solução. Uma resposta desses alunos um tanto quanto plausível
seria considerar o produto na equação ser a água e os íons de Na+ e Cl-,
porém essa resposta foi pouco utilizada pelos alunos, assim como a resposta
correta que seria somente a água (3%).
Na figura 2 no final, foi feito um comparativo entre as respostas dos
grupos.
Pode-se perceber que no grupo 3, há um entendimento maior do assunto,
considerando o percentual de respostas água e também um entendimento que em
solução há a formação de íons sódio e cloreto em água. Nos grupos 1 e 2 é
alarmante o numero expressivo de respostas cloreto de sódio (NaCl), sem
levar em conta o equilíbrio químico dos produtos.
Na pergunta quatro foi esperado que com o auxílio das explicações do
enunciado das questões 1 e 2, fossem facilitar a resolução dessa questão,
mas o que foi visto é que muito não entenderam e por isso nem responderam.
De acordo com as perguntas seria ideal que as respostas certas fossem que
sim, o NH4Cl é um ácido de Arrhenius, pois aumentam a concentração de ions
H+ em solução aquosa e que o NaHCO3, CaO e o MgO são bases de Arrhenius,
pois aumentam a concentração de OH- em solução aquosa. No gráfico dentro da
figura no final mostra as respostas dadas por eles separadas em categorias
na sua totalidade.
Segundo o gráfico mostra que 35% dos alunos conseguiram identificar
corretamente os ácidos e as bases, porém é de se abismar o numero de pessoas
que apenas identificaram as funções químicas, respondendo que só havia sais
e óxidos, não levando em conta a natureza das reações. Esse resultado
corresponde a 19% dos alunos. Outro dado alarmante é o numero de pessoas que
ou responderam errado, ou simplesmente não responderam totalizando um
universo de 35%. Muitos foram contraditórios com as respostas dadas na
primeira e na segunda questão, pois ao responderem que ácidos não precisam
ter hidrogênio na fórmula e bases não precisam ter hidroxila, deveriam ser
capazes de identificar corretamente as substâncias ácidas e básicas
incluídas nessa questão e não foi o caso.
Nas justificativas pegamos exemplos de respostas que até são corretas mais
que há equívocos em suas definições:
“Sim, apenas o NH4Cl é uma ácido de Arrhenius, pois apresenta H+ em sua
estrutura e por isso ele o libera em água”.
Outra definição equivocada.
“O NaHCO3 possui hidrogênio em sua formula e por isso ele é um ácido”.
Nesses exemplos ficam evidentes o aparecimento de obstáculos
epistemológicos. Outro exemplo que fica notório esse equívoco é a
caracterização da substância apenas por sua estrutura e não por sua reação.
O que faz ficar marcado, como a abordagem do tema funções inorgânicas leva o
aluno a apenas se prenderem as classificações, segue o exemplo da resposta
abaixo.
“Não, pois NH4Cl e o NaHCO3 são sais e CaO e o MgO são óxidos”.
Na ultima imagem da figura 2, observamos uma comparação entre as respostas
dos Grupos 1, 2 e 3. Fica evidenciado que certamente o grupo 3, têm mais
domínio do assunto pela maior percentual de acertos e que os grupos 1 e 2,
ainda estão presos há definições de livros didáticos, onde também fica
evidenciado o pouco conhecimento do próprio assunto. Observamos também que
de forma geral tais dados revelaram que alguns daqueles que responderam
corretamente nas duas primeiras questões erraram na quarta, ou seja, ainda
estavam confusos sobre a definição ácido-base de Arrhenius.

Questionário aplicado aos participantes da pesquisa
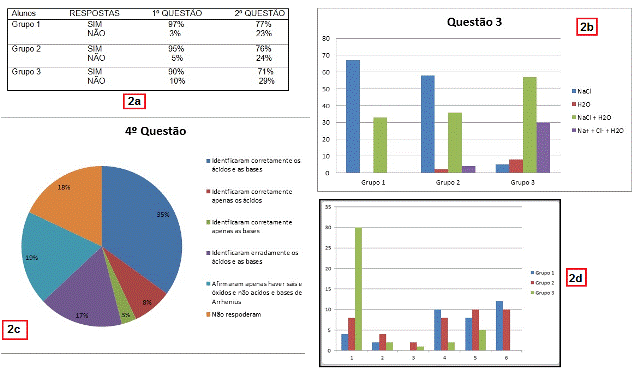
Representação gráfica dos resultados da pesquisa.
Conclusões
Embora a intervenção pedagógica realizada não faça parte das atividades de estágio curricular supervisionado do licenciando-pesquisador, cabe destacar a importância das idas e voltas à Escola, de ensino médio, durante um curso de formação inicial de professores. E neste trabalho, o local de estágio favoreceu a especulação inicial. Corroborando com o que afirma Lima (2012), que é nos primeiros passos de um estágio supervisionado que o licenciando inicia a sua identidade profissional. O trabalho desenvolvido permitiu entender o quanto é incentivador esse contato do licenciando com o contexto real de professor em seu exercício profissional. Pode-se investigar como o professor do ensino médio se desdobra na abordagem de um determinado conteúdo disciplinar, e como, em muitas das vezes, esse mesmo professor fica preso aos conteúdos que são preconizados nos chamados currículos mínimos. Vê-se a necessidade que tal currículo deva ser atualizado para que assim se possa dinamizar os processos de ensino aprendizagem do estudante. O tópico funções inorgânicas é ensinado largamente no ensino médio, principalmente por fazer parte do currículo mínimo, e é ainda muito usado nos clássicos livros didáticos do ensino médio. É necessária, como exposto antes, uma abordagem mais dinâmica, para este assunto em destaque. É importante destacar mais as reações químicas, e como elas acontecem, sem se prender unicamente às classificações. Também defendemos que certos autores, e até mesmo os professores, precisam tomar cuidado com esses obstáculos epistemológicos, e procurar romper com “certas tradições” do ensino de química.
Agradecimentos
Agradecemos ao IFRJ- Campus Nilópolis pela possibilidade da pesquisa.
Referências
ARRHENIUS, S. Development of the theory of electrolytic dissociation. Proceedings of the Royal Institution, p. 45-58, 1904. Disponível em: https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/arrhenius-lecture.pdf. Acesso em: Jul. 2017.
BACHELARD, G. A formação do espírito científico. Rio de Janeiro: Contraponto, 2001.
CAMPOS, R.C.; SILVA, R.C. Funções da química inorgânica... funcionam? Química Nova na Escola, n. 9, p. 18-22, 1999.
DOUGLAS, B.; McDANIEL, D.; ALEXANDER, J. Concepts and models of inorganic chemistry. 3. ed. New York: Wiley, 1994.
KOTZ, J.C.; TREICHEL JR., P.M. Química geral e reações químicas. v. 1. Trad. F. M. Vichi. 5. ed. São Paulo: Thomson, p. 136-138, 2005.
LIMA, M.S. L. Estágio e Aprendizagem da profissão docente. Brasília: Liber Livro, 2012.
MALDANER, O. A. A Pesquisa como perspectiva de formação continuada de professores de química. Química Nova, v. 22, n. 2, p. 289-292, 1999.
MORTIMER, E.F. A evolução dos livros didáticos de química destinados ao ensino secundário. Em Aberto (Brasília), a. 7, n. 40, p. 25-41, out./dez. 1988.
SILVA, L. A.; LARENTIS, A. L.; CALDAS, L. A.; RIBEIRO, M. G. L.; ALMEIDA, R. V.; HERBST, M.H. Obstáculos Epistemológicos no Ensino-Aprendizagem de Química Geral e Inorgânica no Ensino Superior: Resgate da Definição Ácido-Base de Arrhenius e Crítica ao Ensino das “Funções Inorgânicas”. Química Nova na Escola, v. 36, n. 4, p. 261-268, 2014.
USBERCO, João; Salvador, Edgard. Química Geral. 12ª.ed. São Paulo: Saraiva, p. 480, 2006.
































