Uso de embalagens de leites fermentados no estudo e compreensão do fenômeno de hibridação dos orbitais químicos
ISBN 978-85-85905-21-7
Área
Ensino de Química
Autores
Mariano, K.A.S. (COLUNI/UFV) ; Mascarenhas, M.S. (COLUNI/UFV) ; Monteiro, A.A. (COLUNI/UFV)
Resumo
Determinadas áreas temáticas no aprendizado de química apresentam dificuldades para compreensão do aluno, por apresentarem conteúdos com certa abstração, exigindo criatividade e motivação por parte dos educadores para que ele seja assimilado com mais clareza. Na pesquisa foram desenvolvidos modelos alternativos feitos com embalagens de leite fermentado no estudo da hibridação do carbono (sp3, sp2 e sp). As embalagens simulam os orbitais, área em que os elétrons são mais prováveis de serem encontrados para a realização de ligações químicas. A pesquisa possibilitou uma forma criativa, a partir de materiais lúdicos de baixo custo, associada à responsabilidade socioambiental no estudo da hibridação do carbono fazendo com que o aluno participe e interaja melhor sobre o tema abordado.
Palavras chaves
modelos químicos; hibridação do carbono; geometria molecular
Introdução
As atividades experimentais no ensino de química são de grande importância para que determinados conteúdos possam ser assimilados com mais compreensão e maior interesse. É importante criatividade nos métodos para que o aprendizado seja eficaz e motivador. O estudo da hibridação é um tema desafiador porque exige uma visão tridimensional das moléculas, algo nem sempre bem visualizado pelos discentes. A teoria da hibridação dos orbitais atômicos fornece explicações para compreendermos a geometria espacial observada experimentalmente nas moléculas (BARBOSA, 2004). Para a formação de compostos, os átomos devem interpenetrar seus orbitais semipreenchidos na formação da ligação química e conforme a maneira pela qual ocorre a interpenetração resultará em um tipo de ligação covalente: sigma (σ) ou pi (π). A ligação σ ocorre quando os orbitais se interpenetram frontalmente num mesmo eixo, enquanto a π, os orbitais interpenetram segundo eixos paralelos (FONSECA, 2007). A hibridação sp3 é verificada nos compostos quando o carbono faz 4 ligações covalentes iguais tipo σ. O arranjo espacial prova-se que o ângulo máximo entre os 4 orbitais é de 109º 28’ formando um tetraedro imaginário. A hibridação sp2 ocorre quando o carbono faz 3 ligações σ e uma ligação π. A disposição espacial dos orbitais híbridos é trigonal plana, portanto, os ângulos são próximos de 120º. O orbital p é perpendicular aos sp2 na formação da ligação π. A hibridação sp é quando o carbono faz 2 ligações σ e 2 π, sendo que a disposição espacial entre os orbitais híbridos é linear com ângulo de 180º e os orbitais p perpendicular entre si e aos híbridos (BARBOSA, 2004 e FELTRE, 2008). A pesquisa teve como objetivo construir modelos alternativos a partir de embalagens na simulação da hibridação das moléculas.
Material e métodos
A pesquisa foi realizada no Colégio de Aplicação COLUNI/UFV sendo feita uma campanha com os alunos, funcionários e professores para a coleta de potinhos vazios de leite fermentado do tipo Yakult, Chamyto, Batavinho e outras marcas. Durante a campanha explicou-se os objetivos do projeto em questão e de que forma ele auxiliaria no processo de aprendizagem de química orgânica. As embalagens simularam os orbitais nas ligações entre os átomos das moléculas. Os materiais usados para confecção dos modelos foram embalagens de leite fermentado, bastão de cola quente, aplicador de cola quente, fita adesiva azul e vermelha (para diferenciar os orbitais híbridos e os orbitais p), bolinhas de isopor, fios de cobre, velcro e tesoura. Na montagem dos modelos os átomos de carbono na hibridação sp3 são formados por 4 orbitais híbridos na camada de valência que foram representados por 4 embalagens unidas com cola quente formando um tetraedro (109º 28’). Na hibridação sp2 do carbono, a geometria espacial é trigonal plana (120º) e possui, na camada de valência, três orbitais híbridos sp2 e um orbital p perpendicular aos orbitais híbridos. Para a representação do orbital híbrido foi utilizada somente uma embalagem revestida de fita vermelha e duas embalagens revestidas de fita azul para a representação de cada orbital do tipo p simulando um halter. Já o carbono da hibridação sp é formado por 2 orbitais híbridos com geometria linear (180º) representados por 2 embalagens e 2 orbitais p perpendiculares entre si e aos orbitais híbridos. As bolinhas de isopor simularam os átomos de hidrogênio e foram unidas com velcro aos átomos de carbono para formar moléculas. O fio de cobre foi usado para fazer a ligação π entre os orbitais do tipo p.
Resultado e discussão
Na construção do modelo alternativo da hibridação sp3 do carbono foram
utilizadas 4 embalagens. A Figura 1A é representada a disposição dos potinhos na
formação do tetraedro que é a geometria espacial dessa hibridação. Os potinhos
foram revestidos com fita vermelha indicando que todos os orbitais são híbridos.
A Figura 1B é representada a disposição dos potinhos na formação da molécula com
geometria trigonal plana, própria da hibridação sp2. Foram unidos três potinhos
no mesmo plano com ângulo de 120º representando cada orbital híbrido e 2
potinhos representando um único orbital p que fica perpendicular aos híbridos
revestidos em azul. A Figura 1C mostra a disposição dos potinhos na formação da
molécula com geometria linear própria da hibridação sp. Foram unidos dois
potinhos no mesmo plano com ângulo de 180º representando os 2 orbitais híbridos
na cor vermelha. Essa hibridação possui 2 orbitais p, sendo que cada um orbital
foi representado por 2 potinhos simulando um halter. Os orbitais p ficam
perpendiculares aos híbridos. Os átomos de hidrogênio são representados pelas
bolinhas de isopor. A Figura 2 A representa o gás etano que possui somente
ligação simples. A Figura 2 B representa o gás eteno, que possui uma ligação
dupla entre carbonos. A Figura 2 C representa o gás etino que possui uma
ligação tripla entre carbonos.
As embalagens que representam os orbitais p foram furadas e fixadas os fios de
cobre na representação da ligação π que ocorre quando esses orbitais estão
paralelos. Os profissionais da área utilizam os modelos de pinos e bolinhas para
as representações dos átomos e das ligações nas cadeias carbônicas facilitando o
aprendizado, porém, os modelos mais comuns não diferenciam, com clareza, a
ligação do tipo σ da ligação π nos compostos insaturados.

Figura 1. Representação das hibridações do átomo de carbono feitas com embalagens. A: hibridação sp3; B: hibridação sp2; C: hibridação sp.
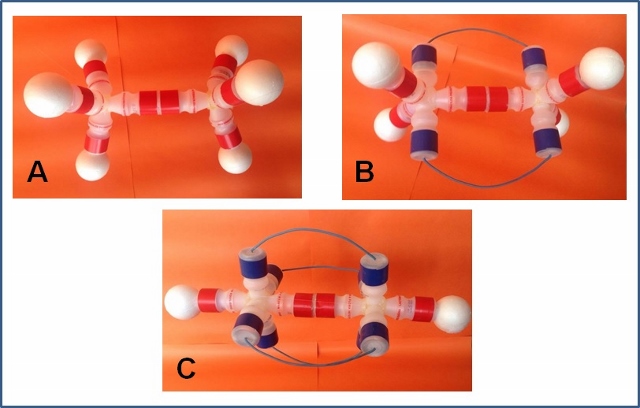
Figura 2. Modelos das estruturas químicas feitas com embalagens de leite fermentado. A: etano; B: eteno e C: etino.
Conclusões
Os modelos químicos, desenvolvidos na pesquisa, com materiais alternativos mostraram-se adequados como método lúdico de ensino, uma vez que, as formas tridimensionais das moléculas, nem sempre são bem visualizadas e compreendidas pelos alunos no aprendizado sobre hibridação. Portanto, como resultado, obteve-se uma maneira mais pragmática de exemplificar o conteúdo abordado em sala de aula associado à responsabilidade ambiental, sendo o material o objeto de estudo dos estudantes do terceiro ano do ensino médio do Colégio de Aplicação COLUNI/UFV.
Agradecimentos
Ao CNPq e à FAPEMIG pela concessão das bolsas científicas aos alunos do PIBIC-EM, a CAPES pelo apoio e aos alunos do Cap-COLUNI pela campanha das embalagens de leite
Referências
BARBOSA, Luiz Cláudio de Almeida. Introdução à Química Orgânica- São Paulo: Ed. Pearson Prentice Hall, 2004.
FELTRE, Ricardo. Química Orgânica 3, 7ª edição – São Paulo: Ed. Moderna, 2008.
FONSECA, Martha Reis Marques da. Química Orgânica, São Paulo: Ed. FTD, 2007.
































