MODIFICAÇÃO ESTRUTURAL DE CONSTITUINTES ISOLADOS DE ÓLEOS ESSENCIAIS ATRAVÉS DE REARRANJO DE FERRIER
ISBN 978-85-85905-23-1
Área
Química Orgânica
Autores
de Freitas Filho, J.R. (DQ/UFRPE) ; Rufino de Freitas, J.C. (CES/UFCG) ; Avelino, R.A. (DQ/UFRPE) ; Rufino de Freitas, J.J. (UACSA/UFRPE)
Resumo
Neste trabalho, descreve-se a modificação estrutural de constituintes isolados de óleos essenciais para potencialização das atividades inseticidas. A metodologia consistiu inicialmente na síntese do tri-O- acetil-D-glical a partir da D-glicose mediada por irradiação de ultrassom. Em seguida, o tri-O-acetil-D-glical foi reagido com o geraniol e citronelol em presença de montmorilonita K-10 como catalisador que resultou no citronelil e geranil 4,6-di-O-acetil-2,3-didesoxi-α-D-eritro-hex-2- enopiranosídeo em bons rendimentos, que após hidrólise básica resultou em citronelil e geranil 2,3-didesoxi-α-D-eritro-hex-2-enopiranosídeo, respectivamente. As estruturas dos hex-2-enopiranosídeos foram elucidadas por técnicas espectroscópicas de infravermelho (IV) e RMN 1H e 13C.
Palavras chaves
Terpenos; Modificação estrutural; Rearranjo de Ferrier
Introdução
A procura por substâncias que apresentem potencialidades biológicas é de suma importância para a sociedade, uma vez que há necessidade da introdução de medicamentos no mercado. Uma boa fonte de obtenção de substâncias com essas finalidades são oriundas de produtos naturais, que apresentam em sua composição estruturas com princípios ativos relevantes.1 Em 2014, Chung e colaboradores2 isolaram três glicosídeos contendo unidade terpênica como aglicona, o ursano-3β,19α,22β-triol-3-O-β-D-glicopiranosil (2′→1″)-β-D-glicopiranosideo, ursano-3α,11-β-diol-3-O-α-D-glucopiranosil- (6′→1″)-α-D-glicopiranosil-(6″→1‴)-α-D-glicopiranosyl -(6‴→1‴′)-α-D- glicopiranosideo e lanosto-5,24-dien-3β-ol-3-O-β-D-glicopiranosil-(6′→1″)-β- D-glicopiranosil-(6″→1‴)-β-D-glicopiranosideo, da erva Ginseng vermelho exibiram atividades anti-inflamatórias contra células da linhagem RAW 264,7 de macrófagos murínicos. As estruturas dos triterpenos foram elucidadas por técnicas espectroscópicas, tais como, infravermelho, RMN 1H e 13C , COSY, HMBC e MS. Os glicosídeos 2,3-insaturados podem ser obtidos através da reação de glicais com nucleófilos, podendo render o O-, C-, N- ou S-glicosídeo, dependendo do tipo de ligação pela qual a parte aglicônica se liga ao C-1 do carboidrato. Os O-glicosídeos podem ser preparados através de um rearranjo alílico do glical na presença de um álcool e um ácido de Lewis como catalisador. Esse rearranjo alílico é atualmente conhecido como rearranjo de Ferrier. Em 1969, Ferrier e Prasad3 relataram a síntese de glicosídeos 2,3- insaturados através do rearranjo alílico do tri-O-acetil-D-glical pela reação de diferentes alcoóis na presença de BF3.Et2O como catalisador. Neste mesmo trabalho,3 foi estabelecido procedimento experimental geral para a síntese de derivados alquílicos de O-glicosídeos 2,3-insaturados. Ferrier e Prasad utilizaram diferentes solventes, temperaturas, catalisadores e alcoóis, observando apenas que as proporções dos confômeros α e β mudavam consideravelmente. Novas metodologias vêm sendo desenvolvidas para a síntese de glicosídeos 2,3-insaturados, onde tem se buscado a utilização de diferentes ácidos de Lewis como catalisadores, reações eficientemente mais limpas e com tempos reacionais curtos. Um exemplo foi o já citado trabalho de Oliveira e colaboradores,4,5 que obtiveram O-glicosídeos 2,3-insaturados com o auxílio de irradiação de micro-ondas. Recentemente, Liu et al.6 relataram a síntese de O-glicosídeos 2,3- insaturados utilizando o rearranjo de Ferrier, onde primeiramente o grupo de saída na posição C-3 do tri-O-acetil-D-glical ou hexa-O-acetil-D-lactal é removido na presença do catalisador Hf(OTf)4 (Esquema 1), formando no anel um cátion como intermediário que é atacado pelo nucleófilo, alcoois ou tiois, para formar uma nova ligação glicosídica. Ao término da reação e purificação, os autores observaram altos rendimentos na utilização de nucleófilos sem muitas ramificações; e baixo rendimento ao utilizar nucleófilos ramificados, no entanto os compostos foram obtidos com maior estereoseletividade em favor do α-anômero (α/β variando de 83:17 a 99:1).6 Esquema 1. Síntese de O-glicosídeos 2,3-insaturados utilizando como catalisador o catalisador Hf(OTf)4 Nos últimos anos, foram realizados progressos consideráveis na síntese de O-glicosídeos. Apesar de sua química desafiadora, devido à sua versatilidade, os O-glicosídeos 2,3-insaturados desempenham um papel fundamental no desenvolvimento da química de novos materiais e na química de moléculas bioativas. Neste trabalho, descreve-se a modificação estrutural de constituintes isolados de óleos essenciais, através da reação de sintese de O-glicosídeo 2,3-insaturados, contendo como aglicona unidades terpênicas, de modo a potencialização das atividades inseticidas.
Material e métodos
Os reagentes e solventes foram obtidos dos fornecedores Merck, Aldrich, Cinética e Vetec. O hexano e o acetato de etila foram destilados antes do seu uso em coluna de Vigreux. O diclorometano anidro utilizado nas reações foi seco através de refluxo em cloreto de cálcio, seguido de destilação. O acompanhamento das reações foi feito através de cromatografia em camada delgada (TLC), onde utilizamos cromatofolhas de sílica-gel, contendo indicador fluorescente F254, da Macherey/Nagel (Dúren, Alemanha). Para revelação dos compostos foi utilizada luz ultravioleta, cuba contendo sistema de H2SO4/EtOH e/ou vapores de iodo. Para cromatografia em coluna foi utilizada sílica gel 60 (Merck, 70-230 mesh). Os espectros de infravermelho com transformada de Fourier foram obtidos com o equipamento Varian modelo 640 FTIR. Os espectros de RMN de 1H e de 13C foram obtidos no equipamento VNMRS (400 MHz para hidrogênio e 100 MHz para carbono), usando CDCl3 como solvente e tetrametilsilano (TMS) ou o sinal residual do solvente como padrão interno de referência. Síntese de O-glicosídeos 2,3-insaturados7-11 A um balão de fundo redondo (125 mL) foi adicionado o tri-O-acetil- D-glucal 1 (1 mmol), os alcoois 3ab (1,5 mmol) e 30 mL de CH2Cl2 anidro. O meio reacional foi adicionado a temperatura de 0 ºC a Montmorilonita K-10 (30% p/p de 22). A mistura foi deixada em refluxo por 3 horas, sendo a reação acompanhada por CCD em sistema CH2Cl2:AcOEt (9:1). Após a reação a mistura foi filtrada e o solvente removido sob pressão reduzida. O produto foi purificado por cromatografia em coluna de sílica gel, utilizando um sistema eluente de hexano:AcOEt (9:1). Reação de hidrólise básica12 Aos compostos 4ab foi adicionado, separadamente, uma mistura de metanol : água : trietilamina (9:6:1) e deixado sob agitação por 3 horas. O produto foi concentrado sob pressão reduzida e purificado por cromatografia em coluna de sílica gel num sistema hexano:AcOEt (7:3). Determinação da Atividade citotóxica Os ovos de Artemia salina foram colocados para eclodirem em solução de sal marinho, e iluminação artificial. Decorridas 24 horas de eclosão, 10 larvas foram adicionadas em tubos de ensaio contendo soluções dos O-glicosídeos 2,3-insaturados de concentrações que variaram de 100 à 2,5 μg/mL em DMSO, todas estando em triplicatas. Para grupo controle uma triplicata de solução de sal marinho e DMSO foi preparada.
Resultado e discussão
A reação de glicosilação entre o tri-O-acetil-D-glucal (1) e o respectivo
álcool (2ab) foi realizada em CH2Cl2 seco, na presença de montmorilonita K-
10 como catalisador, sob refluxo (Esquema 2). Os compostos 3ab foram obtidos
em um tempo reacional de 3 horas, com rendimentos vadiando de 92% e 94%,
respectivamente.
Esquema 2 – Síntese de O-glicosídeo 2,3-insaturado.
O catalisador utilizado funciona como um ácido de Lewis, aceitando
os pares de elétrons provenientes dos oxigênios do glical 1 (Esquema 3). A
ligação C-O, localizada no C-3, fica mais vulnerável a quebra que as demais.
No ato da quebra, uma reestruturação molecular alílica forma possivelmente a
espécie alílica oxônio 5. Esta espécie complexa com o ácido de Lewis
favorecendo o anômero α.
Esquema 3 – Influência do catalisador no rearranjo alílico.
Os compostos 4ab foram submetidos a uma hidrólise básica em um
sistema de metanol : água : trietilamina na proporção de 9:6:1 (Esquema 4).
Esta reação foi realizada utilizando o método de Fraser-Reid e
colaboradores.13 Os produtos 6ab foram obtidos em rendimentos de 86% e 88%,
respectivamente, em um tempo de reação de 3 horas.
Esquema 4 – Hidrólise básica dos compostos 4ab
A obtenção dos compostos 6ab foi confirmada através das análises de
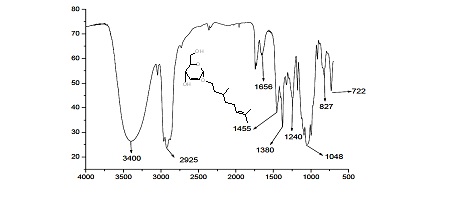
IV, RMN 1H e RMN 13C. No espectro de IV (Figura 1) foi observado o
desaparecimento da banda em 1740 cm-1, referente aos estiramentos das
carbonilas dos grupos OAc do anel piranosídico, e o surgimento de uma banda
forte e larga na região de 3400 cm-1, comprovando a substituição dos grupos
OAc pelos grupos hidroxila. Os espectros de RMN 1H e 13C do composto 6a
encontram-se em anexo.
Figura 1 – Espectro de IV do composto 6a em pastilha de KBr.
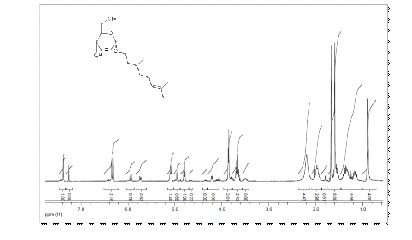
O espectro de RMN 1H do composto 6b mostrou um simpleto largo em δ 4,89 ppm
referente ao hidrogênio anomérico (Figura 2). Em δ 5,83 ppm aparece um
dupleto referente ao acoplamento do hidrogênio H-3 com o H-2, em δ 5,84 ppm
aparece outro dupleto referente ao acoplamento de H-2 com o H-3. Com relação
à parte aglicônica, o pico referente ao hidrogênio vinilico aparece como um
tripleto na região de 4,81 ppm; na região de 1,36 ppm aparece um multipleto
referente a metina e na faixa de δ 0,89 ppm aparece um simpleto corresponde
ao grupo metila ligado a dupla ligação.
Figura 2 – Espectro de RMN 1H do composto 6b. (CDCl3, 300 MHz)
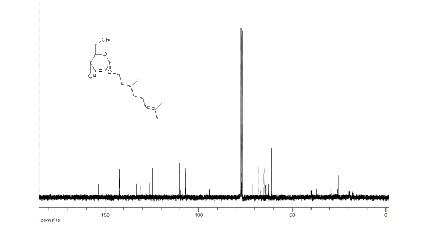
Com relação ao espectro de RMN 13C (Figura 3) foi observado um sinal na
região de δ 66.7 ppm referente ao carbono C-5 do anel piranosídico, já o
carbono anomérico C-1 apresentou dois sinais na região de δ 95,6 ppm, devido
a presença do anômero α. Os carbonos C-2 e C-3 do carboidrato aparecem na
região de δ 125,2 e 129,4 ppm, respectivamente. O sinal na região de 65,3
ppm corresponde ao carbono metilênico vizinho ao oxigênio da parte
aglicônica.
Figura 2 – Espectro de RMN 13C do composto 6b (CDCl3, 75 MHz)
Atividade Citotóxica
A citotoxicidade dos O-glicosídeos 2,3-insaturados (4ab e 6ab) sintetizados,
foram avaliadas frente a Artemia salina. McLaughlin et al.,14a,b relataram
que a citotoxicidade dos compostos frente a Artemia salina tem relação com a
atividade antitumoral, e que este bioensaio pode ser efetuado como um teste
preliminar para posteriores teste de atividades antitumorais. O percentual
de mortalidade dos compostos frente a Artemia salina foi calculado após 24
horas e verificou-se que após esse tempo o percentual de mortalidade foi
100% em todas as concentrações que variaram de 2,5-100 µ /mL.
Tendo em vista os resultados dos testes frente à Artemia salina, podemos
observar que os compostos são bastante citotóxicos devido a porcentagem de
microcrustáceos mortos para este teste, e isso nos levando a crer que os
compostos podem vir a apresentar boas atividades biológicas em outros
bioensaios.
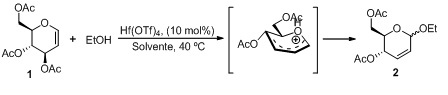
Síntese de O-glicosídeos 2,3-insaturados utilizando como catalisador o catalisador Hf(OTf)4
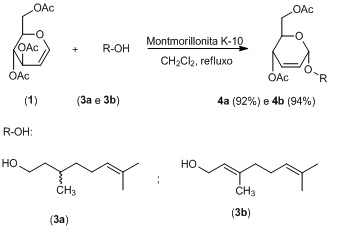
Síntese de O-glicosídeo 2,3-insaturado.
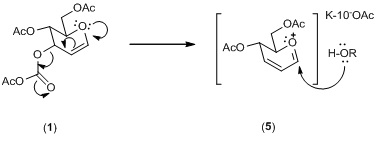
Influência do catalisador no rearranjo alílico.
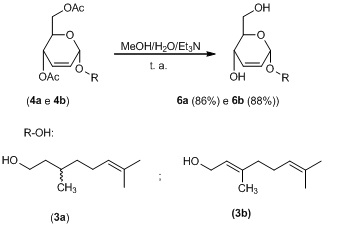
Hidrólise básica dos compostos 4ab
Espectro de IV do composto 6a em pastilha de KBr.
Espectro de RMN 1H do composto 6b. (CDCl3, 300 MHz)
Espectro de RMN 13C do composto 6b (CDCl3, 75 MHz)
Conclusões
Neste trabalho foi descrito a sínteses de novos O-glicosídeos 2,3-insaturados a partir do tri-O-acetil-D-glucal. Os alcoóis utilizados para a reação de glicosilação foram os monoterpenos - citronelol e geraniol. A reação de glicosilação foi realizada por metodologia já descrita na literatura, utilizando montmorilonita K-10 como catalisador e CH2Cl2 como solvente. Os O- glicosídeos 2,3-insaturados 4ab obtidos foram submetidos a uma reação de hidrólise básica para fornecer os dióis 6ab com rendimentos variando de 86% a 88%, respectivamente, em um tempo de reação de 3 horas. Foram realizadas as atividades citotóxicas de quatro (4) novos O-glicosídeos 2,3-insaturados frente a Artemia salina, e verificou-se que após 24 horas o percentual de mortalidade dos microcrustáceos foi 100% em todas as concentrações que variaram de 2,5-100 µ /mL, o que demonstra que os compostos apresentam potenciais para testes em outros bioensaios.
Agradecimentos
A FACEPE pelo apoio e bolsa concedida.
Referências
1. Newman, D. J.; Cragg, G. M.; J. Nat. Prod. 2007, 70, 461.
2. Freitas, J. C. R.; Couto, T. R.; Paulino, A. A. S.; Freitas Filho, J. R.; Malvestiti, I.; Oliveira, R. A.; Menezes, P. H.; TetrahedronLett. 2012, 68, 8645 e referências citadas.
3. Ferrier, R. J.; Prasad, N. J. Journal of the Chemical Society C-Organic. 1969, 570.
4. De Oliveira, R. N.; de Freitas Filho, J. R.; Srivastava, R. M. Tetrahedron Letters. 2002, 43, 2141-2143.
5. Costa, P. L. F.; Melo, V. N.; Guimarães, B. M.; Schuler, M.; Pimenta, V.; Rollin, P.; Tatibouët, A.; Oliveira, R. N.; Carbohydr. Res. 2016, 436, 1 e referências citadas.
6. Liu, Y.; Song, T.; Meng, W.; Xu, Y.; Wang, P. G.; Zhao, W.; Tetrahedron Lett. 2016, 57, 2758.
7. Toshima, K.; Ishizuka, T.; Matsuo, G.; Nakata, M. Synlett. 1995, 4, 306-308.
8. Santos, J. A. M.; Santos, C. S.; Almeida, C. L. A.; Silva, T. D. S.; Freitas Filho, J. R.; Militão, G. C. G.; Silva, T. G.; Cruz, C. H. B.; Freitas, J. C. R.; Menezes, P. H.; Eur. J. Med. Chem. 2017, 128, 192.
9. Freitas Filho, J. R.; Srivastava, R. M.; Silva, W. J. P.; Cottier, L.; Sinou, D.; Carbohydr. Res. 2003, 338, 673.
10. Freitas Filho, J. R.; Freitas, J. J. R.; Cottier, L.; Sinou, D.; Srivastava, R. M.; J. Chil. Chem. Soc. 2015, 60, 2646.
11. Regueira, J. L. L. F.; Dantas, C. R.; Freitas, J. J. R.; Silva, A. J. F. S.; Freitas Filho, J. R.; Menezes, P. H.; Freitas, J. C. R.; Synthesis. 2016, 48, 1069.
12. Fraser-Reid, B.; Mclean, A.; Usherwood, E. W. Journal of the American Chemical Society. 1969, 91, 5392.
13. Fraser-Reid, B.; Mclean, A.; Usherwood, E. W.; Yunker, M. Canadian Journal of Chemistry. 1970, 48, 2877.
14. a) MCLAUGHLIN, J. L. Methods in plant biochemistry, v. 6. Londres: Academic Press, 1991. b) Freitas, L. A. B.; Estudo fitoquímico e atividade biológica das raízes, folhas, caules e frutos de Piper caldense C. DC. (PIPERACEAE). 2014. 79f. Monografia – Departamento de Química, Universidade Federal Rural de Pernambuco, Recife.











