Sintese e avaliação da atividade antioxidante de derivados β-cetoindóis
ISBN 978-85-85905-23-1
Área
Química Orgânica
Autores
Lemes, E.O. (UEG) ; Awad, R. (UEG) ; Queiroz, J.E. (UEG) ; Pereira, P.A.G. (UNB) ; Souza, P.E.N. (UNB) ; Thomaz, D.V. (LAFAM - UFG) ; Caetano, M.P. (LAFAM - UFG) ; Gil, E.S. (LAFAM - UFG) ; Vila Verde, G.M. (UEG) ; Aquino, G.L.B. (UEG)
Resumo
Antioxidantes retarda/inibi processos de oxidação causados por ERO e defende contra patologias causadas por radicais livres. A deslocalização eletrônica e presença de grupos doadores de elétrons aumenta atividade antioxidante. Derivados indólicos são moléculas biologicamente ativas, como β-cetoindol; são obtidos por vários métodos (Michael, Friedel-Crafts ou aza-Diels-Alder) sob condições indesejadas. Assim, esta pesquisa utiliza irradiação de microondas para otimizar a síntese e faz estudo comparativo da atividade antioxidante. A otimização gerou resultados satisfatórios (rendimentos similares/maiores que literatura) e melhora no tempo (6h - 5 min) e solvente (10 - 0,5 ml). No DPPH, a presença de flúor/bromo aumentou a atividade. Na VPD, o indol metilado foi significativo para atividade.
Palavras chaves
derivados β-cetoindois; irradiação de microondas; atividade antioxidante
Introdução
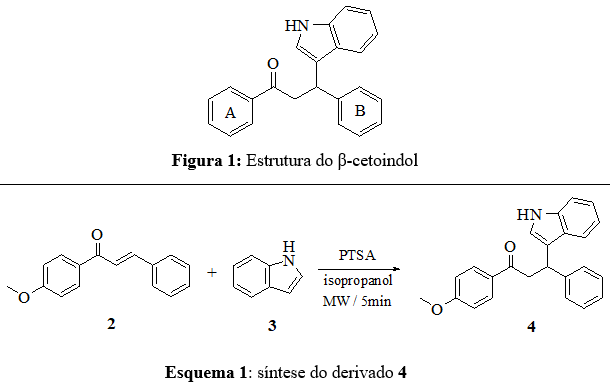
Antioxidantes são moléculas que possuem a capacidade de retardar ou inibir os processos de oxidação que ocorrem sob influência atmosférica do oxigênio ou espécies reativas de oxigênio/nitrogênio (ERO/ERN) e no mecanismo de defesa do organismo contra as patologias associadas aos radicais livres. O excesso de radicais livres pode levar ao câncer, aterosclerose, doença cardiovascular, mal de Parkinson e diabetes mellitus. Os antioxidantes podem ser sintetizados in vivo, como a glutationa (GSH) e superóxido dismutase (SOD), ou podem ser utilizados como antioxidantes dietéticos, como a vitamina E/C e o β-caroteno (LIANG et al, 2016; KHAKSAR et al, 2013; BARAKAT et al, 2013). A atividade antioxidante de substâncias orgânicas está relacionada a diversos mecanismos, como eliminação de radicais livres, remoção de oxigênio singleto, doação de hidrogênio ou elétrons, quelação de íons metálicos e atuação como substrato para radicais livres, como superóxido e hidróxido (CHAVAN et al, 2016; FARKAS et al, 2004). O potencial antioxidante é potencializado pela deslocalização eletrônica em anéis aromáticos e por grupos doadores de elétrons, como a amina, hidroxila, metoxila e metila, ligados a anéis aromáticos (AL-SEHEMI & AHMAD IRFAN, 2017; KRAFCZYK et al, 2009). Derivados indólicos despertam a atenção de químicos orgânicos devido à sua presença em muitas substâncias farmacologica e biologicamente ativas, como o β-cetoindol, que é o esqueleto para o desenho de importantes moléculas com diversas atividades biológicas e possuem, no mínimo, quatro anéis aromáticos em sua estrutura que podem ser projetados com diferentes padrões de substituição (Figura 1) (JIANG et al, 2017; MAITI & KUNDU, 2007). Os derivados β-cetoindóis são atrativos devido as suas propriedades biológicas (BIRADAR et al, 2010), como as propriedades antioxidantes (KARAASLAN et al, 2013). No entanto, o mecanismo de ação da interação do indol com espécies reativas não é totalmente compreendido (ESTEVÃO et al, 2010). Sabe-se que esses derivados eliminam ERO’s e ERN’s, como já é relatado em alguns fármacos com indol em sua estrutura, como a indometacina e acemetacina (RAJENDRA et al, 2014). Substâncias com alta atividade antioxidante atuam como protótipos para fármacos no tratamento de doenças de estresse oxidativo, devido ao excesso de radicais livres, como as cardiovasculares, hipertrofia cardíaca, diabetes, esclerose múltipla, esclerose lateral amiotrófica, hipertensão e doenças neurodegenerativas, como a doença de Alzheimer (WOJTUNIK-KULESZAA et al, 2016; FARGHALY et al, 2010). Os derivados β-cetoindóis ainda são pouco explorados em termos de seu potencial biológico (XU et al, 2009). Os derivados β-cetoindóis podem ser obtidos por vários métodos, incluindo a condensação do indol a cetonas α,β-insaturadas via adição de Michael, adição de Friedel-Crafts ou reações de aza-Diels-Alder (HALAWA et al, 2017; HU et al, 2015; ZENG et al, 2007; SHEN et al, 2005). As adições de Michael e Friedel-Crafts são mediadas por ácidos próticos ou ácidos de Lewis e a reação de aza-Diels-Alder utiliza tolueno/xileno como solvente. São métodos que envolvem reagentes caros, solventes perigosos, longos tempos de reação, condições fortemente ácidas, baixo rendimento do produto e manipulação complicada de produtos químicos (JIANG et al, 2017; HU et al, 2015; ZENG et al, 2007). Novos métodos como o uso de irradiação ultrassônica são utilizados na síntese dos derivados β-cetoindóis, a reação é mais eficiente que métodos convencionais, como o refluxo que leva 6 a 10 horas de reação, mas ainda requer horas de reações (2-4h) (ZHANG et al, 2015; QUEIROZ et al, 2015). Assim, novos métodos que utilizem melhores condições e menores tempos de reação são buscados para a síntese desses derivados. O uso da irradiação de microondas na síntese orgânica ganhou destaque nos últimos anos. O método promove redução nos tempos de reação, melhorias na pureza e no rendimento dos produtos, redução na quantidade de solventes e nos níveis de produtos secundários, tornando-o um método verde e sustentável (EGOROVA & ANANIKOV, 2017; HUANG et al, 2016; SANTAGADA et al, 2002). A maioria das metodologias de síntese via irradiação de microondas descritas na literatura utiliza metais como catalisadores, que são considerados produtos tóxicos ao meio ambiente, assim, o estudo de novos catalisadores vem ganhando crescente interesse (LIU, Z et al, 2018; KASOTE et al, 2015; IRFAN et al, 2009). Existe um interesse crescente no design de novas moléculas com capacidade antioxidante, portanto, neste contexto, esta pesquisa utiliza um ácido p- toluenosulfônico orgânico como catalisador na síntese de derivados β- cetoindóis, um novo procedimento rápido e fácil que permite a síntese assistida por irradiação de microondas. Além disso, apresenta um estudo comparativo da atividade antioxidante dos derivados sintetizados via varredura DPPH e voltametria de pulso diferencial (VPD).
Material e métodos
Todos os reagentes e solventes utilizados foram de grau analítico e utilizados como fornecidos. Os cromatogramas e espectros de massas foram obtidos em CG QP2010 Ultra (Shimadzu), equipado com coluna capilar CBP-5; volume de injeção de 1,0μL e hélio como gás de arraste; temperatura do injetor a 280 °C e do detector a 310 °C. A temperatura inicial do forno foi de 100 °C por 2 min, seguida por uma rampa de aquecimento até 300 °C a 30 °C/min e mantida por 10 min. Os espectros de infravermelho foram registrados em um espectrofotômetro FT-IR (PerkinElmer). Os espectros de RMN de 1H e 13C foram realizados num espectrômetro Avance III (Bruker) e os desvios químicos registados em δ em relação a TMS. O progresso das reações foi monitorado por CCD em cromatofolhas de alumínio com sílica gel 60, Alugram® Xtra Sil G, com indicador UV254 e as manchas visualizadas a exposição a vapores de iodo ou câmera UV. A adição do indol a chalcona foi realizada pela mistura de indol ou N- metilindol, chalcona, PTSA e isopropanol (0,5 mL) irradiada em reator de microondas de circuito fechado a 110 ºC e 250 W durante 5 min. Após 5 min, a mistura reacional foi arrefecida e o precipitado filtrado. Sendo recristalizada quando necessário. Para confirmação estrutural foram utilizadas técnicas de Espectrometria de Massas, Ressonância Magnética Nuclear de próton e carbono (RMN 1H/13C) e infravermelho (IV). A atividade sequestradora de radicais livres dos derivados β-cetoindóis foi adaptada de Sivakumar et al (2011). Uma alíquota dos derivados (250 µM) em microplacas de 96 poços com solução de DPPH a 0,1 mM numa proporção de 2:1 foi agitada em vortex por 5 min e incubada no escuro por 30 min e a absorbância medida em leitor de microplacas BioTek, modelo Epoch a 517 nm. Para a Ressonância Paramagnética Eletrônica (RPE) os derivados foram estudados como no método por espectrometria óptica com as medições em espectrómetro Bruker (Bruker EMX Plus, Alemanha). A redução percentual na concentração de DPPH foi calculada usando uma curva de calibração. Para a VPD todos os experimentos foram realizados no estado sólido, pela imobilização por oclusão em pasta de carbono (5 mg de derivado, 70 mg de grafite e 30 mg de óleo mineral), com amplitude de pulso de 50 mV e velocidade efetiva de 10 mV/s. As medidas eletroanalíticas foram realizadas em potenciostato TypeA® μAutolab (Eco-Chemie BV, Utrecht, Holanda) integrado com GPES 4.9®. O dispositivo foi conectado a uma célula eletroquímica de 2 mL em tampão fosfato (0,1 M, pH 7) com o sistema de eletrodo de referência. Como alternativa ao teste tradicional, também foi utilizado o método eletroanalítico, baseado no índice eletroquímico.
Resultado e discussão
A síntese dos derivados β-cetoindóis é descrita na literatura em diferentes
métodos, como o uso de sílica impregnada com H2SO4 e ácidos de Lewis como
catalisadores (SmI3, InCl3 e ScCl3). Esses métodos envolvem condições
fortemente ácidas, baixo rendimento, quantidades estequiométricas de
catalisadores e manipulações complexas (MASAGALLI et al, 2014; LI et al,
2014; YU et al, 2009). Assim, este estudo utiliza aquecimento por irradiação
de microondas e ácido p-toluenosulfônico (PTSA) como catalisador para
otimização da síntese.
Os derivados foram obtidos pela condensação de chalconas com indol ou N-
metilindol pela reação de Michael catalisada por ácido, para otimização
realizou-se estudos da adição a chalcona (2) de indol (3) (derivado 4),
esquema 1. O método foi realizado em diferentes catalizadores e solventes.
Primeiro fez-se o aquecimento em H2O e depois utilizou-se os ácidos BF3,
InCl3, SOCl2 e PTSA como catalisadores. Álcool etílico ou isopropílico foram
utilizados como solvente.
Inicialmente a reação foi realizada na ausência de catalisador com
aquecimento próximo à temperatura crítica da água (296ºC), uma vez que
nessas condições a água atua como solvente orgânico (YARAGORLA et al, 2015),
obtendo-se 10% do produto; BF3 e InCl3 não levou a formação do produto e
SOCl2 levou a formação de 12%. No entanto, o uso de PTSA nas mesmas
condições (EtOH; 90ºC; 250W) levou a um rendimento de 66%. Ou seja, a
simples utilização de PTSA levou a uma melhora significativa no rendimento
da reação. A fim de aumentar o rendimento manteve-se a utilização de PTSA e
mudou-se o solvente e a temperatura de aquecimento. O uso de álcool
isopropílico (90ºC; 250W) levou a um rendimento de 84%, elevando a
temperatura para 110ºC, resultou-se em um rendimento de 93%. Assim, 5
minutos de aquecimento a 110ºC e 250W foi escolhido como a melhor condição.
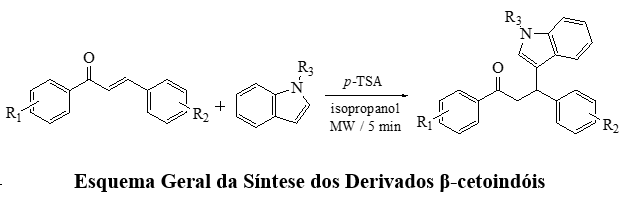
Após a otimização, 27 derivados foram sintetizados utilizando a melhor
condição (5 min; 110ºC; 250W) com rendimentos satisfatórios. Masagalli et al
(2014) e Yu & Liu (2009) descreveram a síntese sob refluxo obtendo
rendimentos superiores a 90% após 6 horas e Li et al (2014) acima de 70%
após 4 horas; Zeng et al (2007) acima de 65% após 6,5 horas de reação via
irradiação ultrassônica. Estes resultados confirmam a eficiência do método
aqui proposto, devido a redução significativa no tempo de reação de horas
para minutos sem reduzir o rendimento e a pureza dos produtos obtidos.
Após a síntese, os derivados foram submetidos a testes de atividade
antioxidante, que possui numerosas metodologias descritas na literatura. A
determinação do método de análise deve considerar a aplicabilidade de cada
tipo de ensaio e recomenda-se o estudo de duas ou mais técnicas. Diferentes
métodos proporcionam maior confiabilidade nos resultados (JIANG et al,
2018).
O potencial antioxidante foi determinado pela captação do radical livre e
estável de DPPH por espectrofotometria e RPE e utilizou-se a VPD para
determinar o potencial antioxidante endógeno.
Para relacionar a estrutura à atividade antioxidante, os derivados foram
separados em dois grupos: p-metoxila ou quaisquer substituintes em R1 (4,
4a-4k) e p-flúor ou p-bromo em R1 (4l-4z).
A posição do substituinte interfere na atividade antioxidante sendo 4f e 4k
os mais ativos neste grupo, destacando-se entre os demais devido a maior
atividade justificada pelos elétrons disponíveis no anel aromático, pelo
efeito de ressonância. Derivados substituídos com p-Br ou p-F no anel B
mostraram melhor atividade quando o anel indólico não é metilado (4g, 4j e
4h).
Para avaliar a influência de grupos eletronegativos no anel A com anel
indólico não metilado, o segundo grupo (4l-4z) foi avaliado.
Derivados com flúor (4b, 4h, 4m e 4u) foram mais ativos que derivados com
bromo (4a, 4g, 4l e 4t), justificado pelo efeito menos eletronegativo do
bromo. O átomo de bromo tem o poder de retirar elétrons através de um efeito
indutivo superior, o que justifica sua menor atividade antioxidante (GROZAV
et al, 2017).
Inverter a posição dos substituintes entre os anéis A e B (4h-4q e 4g-4x)
resultou em aumento significativo na atividade, evidenciando a probabilidade
dos substituintes eletronegativos no anel A terem melhor efeito na atividade
antioxidante.
A presença de metoxilas em R1 interfere na atividade, como resultado do
maior poder de doação de elétrons, o que pode ser verificado em derivados
com bromo ou flúor (4q e 4x) estes resultados também foram observados por
Murti et al (2013). O grupo metoxila tem maior poder doador de elétrons do
que a metila, o que justifica o maior poder antioxidante do derivado 4q em
relação ao 4o e do 4x em relação ao 4w, como também foi observado por
Sivakumar et al (2011).
Os derivados 4s e 4z com o grupo m-nitro no anel B apresentaram maior
atividade quando comparados aos derivados 4r e 4y (p-nitro), ou seja, a
posição meta eleva a atividade antioxidante em relação à posição para. O
mesmo foi observado por Tajammal et al (2017) que evidenciaram a ordem de
reatividade como orto> meta> para. Assim, a inibição do radical depende da
posição do grupo nitro.
Os derivados com p-flúor (4l a 4s) e p-bromo (4t a 4z) no anel A possuem a
mesma variação na atividade antioxidante quando comparados o substituinte no
anel B, com ordem de maior reatividade de m-nitro (4s e 1z) > p-nitro (4r e
4y) > p-metoxila (4q e 4x) > p-metil (4o e 4w) > não substituído (4n e 4v) >
p-flúor (4m e 4t) > p-bromo (4l e 4t) ). A atividade quando comparada para
cada par foi numericamente similar, indicando que tanto o flúor quanto o
bromo têm a mesma influência na atividade.
Os resultados de inibição do radical DPPH por espectrofotometria foram
próximos aos RPE, demonstrando que ambos são eficientes na avaliação da
atividade antioxidante.
Uma substância com potencial atividade antioxidante endógena apresenta o
primeiro pico de oxidação na VPD antes de 0,5V, uma vez que antioxidantes
endógenos oxidam em potenciais em torno desse valor. Substâncias com o
primeiro pico após 0,5V são considerados como baixos antioxidantes, também
se utilizou o Índice Eletroquímico (IE) como parâmetro (JADON et al, 2017;
LINO et al, 2014).
A maioria dos derivados que não apresentaram o primeiro pico <0,5V tem
grupos de retiradores de elétrons no anel A (4l-4z), demonstrando que esses
grupos têm efeito negativo na atividade. Como observado, os derivados que
podem ser considerados como potencial antioxidante endógeno (4, 4a-4g, 4i e
4k), possuem grupos doadores ou não possuem substituintes no anel A.
Observou-se que o aumento da densidade eletrônica devido à inserção de N-
metila no anel indólico resultou em maiores valores de IE quando comparados
aos seus análogos com o indol, principalmente quando comparado o derivado 4b
com seu análogo 4h (não apresentou pico <0,5V).
Os derivados com pico <0.5V não apresentaram substituintes retiradores de
elétrons no anel A, variando em ordem decrescente em 4c (140,23) > 4f
(44,71) > 4k (24,94) > 4a (22,10) > 4b (17,29) > 4e (13,75) > 4d (13,61) >
4g (6,38) > 4i (5,59) > 4 (5,30). Os derivados 4c, 4f e 4k possuem os
maiores IE. 4h, 4j, 4l-4z apresentaram o primeiro pico de oxidação maior que
0,5 V, o que os conferiu baixo potencial antioxidante endógeno.
Os derivados analisados por VPD não apresentaram correlação com o sequestro
do DPPH. No entanto, todos os derivados testados apresentaram
eletroatividade devido à presença de picos de oxidação. As diferenças nos
resultados dos antioxidantes obtidos estão relacionadas às diferenças nos
princípios de cada método (JADON et al, 2017; LINO et al, 2014).
Estrutura do beta-cetoindol e Esquema da síntese do derivado 4
Conclusões
A otimização do método de síntese proposto por esta pesquisa levou a resultados satisfatórios. Os rendimentos dos produtos foram similares ou melhores que os métodos descritos na literatura, como refluxo e irradiação ultrassônica, atingindo 97%, porém houve melhora significativa no tempo de reação (6h para 5 minutos), redução no uso de solvente (10 ml para 0,5 ml) e utilização de um ácido orgânico, PTSA. Assim, o método proposto mostrou-se altamente eficaz em comparação com outros métodos tradicionais de síntese, uma vez que ocorre em menor tempo e utiliza menores quantidades de reagentes, sendo considerada uma técnica de síntese orgânica combinada com a química verde. O uso de DPPH scavenging, por espectrofotometria e RPE, para determinar a atividade antioxidante dos derivados sintetizados, demonstrando que não há necessidade de realizar dois testes com base no mesmo objetivo, uma vez que os resultados foram semelhantes. Os derivados sintetizados apresentaram atividade antioxidante avaliada pela captura do radical livre de DPPH. A presença do grupo flúor ou bromo no anel A dos derivados β-cetoindois conduziu a um aumento da atividade antioxidante dos derivados. Derivados com indol metilado apresentaram pico de oxidação por VPD antes de 0,5V, demonstrando potencial antioxidante endógeno, tornando esses substituintes significativos na atividade antioxidante, sendo necessárias futuras investigações.
Agradecimentos
Os autores agradecem ao CNPq, à CAPES e a FAPEG pelo apoio financeiro e à UEG, UFG e UNB pelo apoio na execução das análises e a todos os envolvidos na interpretação
Referências
AL-SEHEMI, A.G.; IRFAN, A. Effect of donor and acceptor groups on radical scavenging activity of phenol by density functional theory. Arabian Journal of Chemistry, 10, S1703–S1710, 2017.
BARAKAT, A.; ISLAM, M. S.; MAJID, A. M. A. A.; AL-OTHMAN, Z. A. Highly enantioselective Friedel-Crafts alkylation of indoles with α,β-unsaturated ketones with simple Cu(II)-oxazoline-imidazoline catalysts. Tetrahedron, 69, 5185e-192, 2013.
BIRADAR, J. S.; SASIDHAR, B. S.; PARVEEN, R. Synthesis, antioxidant and DNA cleavage activities of novel indole derivatives. European Journal of Medicinal Chemistry, v. 45, p. 4074-4078, 2010.
CHAVAN, B.B.; GADEKAR, A.S.; MEHTA, P.P.; VAWHAL, P.K.; KOLSURE, A.K.; CHABUKSWAR, A.R. Synthesis and Medicinal Significance of Chalcones: A Review. Asian Journal of Biomedical and Pharmaceutical Sciences, 6, 56, 01-07, 2016.
EGOROVA, K. S.; ANANIKOV, P. V. Toxicity of Metal Compounds: Knowledge and Myths. Organometallics, 36, 4071−4090, 2017.
ESTEVÃO, M. S.; CARVALHO, L. C.; RIBEIRO, D.; COUTO, D.; FREITAS, M.; GOMES, A.; FERREIRA, L. M.; FERNANDES, E.; MARQUES, M. M. B. Antioxidant activity of unexplored indole derivatives: Synthesis and screening. European Journal of Medicinal Chemistry, p. 45, v. 4869-4878, 2010.
FARGHALY, A. A. H. Synthesis of some new indole derivatives containing pyrazoles with potential antitumor activity. Arkivoc, v. 2010, n. 11, p. 177-187, 2010.
FARKAS, O.; JAKUS, J.; HÉBERGER, K. Quantitative Structure – Antioxidant Activity Relationships of Flavonoid Compounds. Molecules, 9, 1079-1088, 2004.
GROZAV, A.; PORUMB, I.; GÃINÃ, L. I.; FILIP, L. Cytotoxicity and antioxidante potential of novel 2-(2-((1H-indol-5yl)methylene)-hydrazinyl)-thiazole derivatives. Molecules, v. 22, n. 260, p-1-12, 2017.
HALAWA, A. H.; BEDAIR, A. H.; EL-AGRODY, A. M.; ELIWA, E. M.; FRESE, M.; SEWALD N.; SHAABAN, M. Synthesis and biological activities of new bis-indole derivatives via microwave irradiation. Zeitschrift für Naturforschung B, 72, 9, 639–646, 2017.
HU, H.; MENG, C.; DONG, Y.; LI, X.; YE, J. Catalytic Asymmetric Formal Aza-Diels−Alder Reactions of α,β-Unsaturated Ketones and 3H‑Indoles. ACS Catal., 5, 3700−3703, 2015
HUANG, Y.-B.; YANG, T.; CAI, B.; CHANG X.; PAN, H. Highly efficient metal salt catalyst for the esterification of biomass derived levulinic acid under microwave irradiation. RSC Adv., 6, 2106-2111, 2016.
IRFAN, M.; FUCHS, M.; GLASNOV, T.N.; KAPPE, C.O. Microwave-Assisted Cross-Coupling and Hydrogenation Chemistry by Using Heterogeneous Transition-Metal Catalysts: An Evaluation of the Role of Selective Catalyst Heating. Chem. Eur. J., 15, 11608 – 11618, 2009.
JADON, N.; NIRUPAMA, J.; ARIBAM, N. G.; CHAUHAN. Review – Monitoring of endogenous antioxidants: an electroanalytical approach. Journal of the electrochemical society, v. 164, n. 4, p. 266-267, 2017.
JIANG, J.; CAI, Y.; TANG, LIXIN. A Green and Efficient Michael Addition of Indoles to α,β-unsaturated Electron-deficient Compounds and Synthesis of Bis-indolylmethanes Catalyzed by Gallium Dodecyl Sulfate [Ga(DS)3] in Water. Journal of New Materials for Electrochemical Systems, 20, 31-37, 2017.
JIANG, J.; ZANG, S.; WANG, D. L.; TIAN, S.; YU, A.; ZHANG, Z. Determination of Antioxidant Capacity of Thiol- Containing Compounds by Electron Spin Resonance Spectroscopy Based on Cu 2+ Ion Reduction. Talanta, 2018.
KARAASLAN, C.; KADRI, H.; COBAN, T.; SUZEN, S.; WESTERLL, A. D. Synthesis and antioxidant properties of substituted 2-phenyl-1H-indoles. Bioorganic & Medicinal Chemistry Letters, v. 23, p. 2671-2674, 2013.
KASOTE, D. M.; KATYARE, S. S.; HEGDE, M. V.; BAE, H. Significance of Antioxidant Potential of Plants and its Relevance to Therapeutic Applications. International Journal of Biological Sciences, 11, 8, 982-991, 2015.
KHAKSAR, S.; VAHDAT, S. M.; REZAEE, F. Highly effective and regioselective Michael addition of indoles to a,b-unsaturated ketones promoted by pentafluorophenylammonium triflate. C. R. Chimie, 16, 144–147, 2013.
KRAFCZYK, N.; WOYAND, F.; GLOMB, M. A. Structure–antioxidant relationship of flavonoids from fermented rooibos. Mol. Nutr. Food Res., 635 53, 635 – 642, 2009
LI, S.; LIN, H.; ZHANG, X.; DONG, L. Ruthenium-catalyzed direct C3 alkylation of indoles with α,β-unsaturated ketones. Organic & Biomolecular Chemistry, v. 4, p. 1- 9, 2014.
LIANG, D.; LI, X.; ZHANG, W.; LI, Y.; ZHANG, M.; CHENG, P. Br2 as a novel Lewis acid catalyst for Friedel–Crafts alkylation of indoles with α,β-unsaturated ketones. Tetrahedron Letters, 57, 9, 1027-1030, 2016.
LINO, F. M.A.; SÁ, A,L.Z.; TORRES, I.M.S.; ROCHA, M.L.; DINIS, T.C.P.; GHEDINI,P.C.; SOMERSET, V.S.; GIL, E.S. Voltammetric and spectrometric determination of antioxidant capacity of selected wines, Electrochimical Acta, v.128,p. 25–31,2014.
LIU, Z.; LI, G.; LONG, C.; XU, J.; CEN, J.; YANG, X. The antioxidant activity and genotoxicity of isogarcinol. Food Chemistry, 253, 5-12, 2018.
MAITI, G.; KUNDU, P. Antimony Trichloride –Catalyzed Michael Addition of Indoles to the α,β-Unsaturated Ketones. Synthetic Communications, 37, 2309–2316, 2007.
MASAGALLI, J. N.; MAHADEVAN, K. M.; JAYADEVAPPA, H.; HARISHKUMAR, H, N.; GANALU, R.; NAGARAJA, P. Synthesis and in vitro cytotoxicity study of 3-(1H-indol-3-yl)-1,3diphenylpropan-1-ones. Medicinal Chemistry Research, v. 23, n. 6, p. 2880-2889, 2014.
MURTI, Y.; GOSWAMI, A.; MISHRA, P. Synthesis and antioxidant activity of some chalconas and flavonoids. International Journal of PharmTech Research, v. 5, n. 2, p. 811-818, 2013.
OJTUNIK-KULESZAA, K. A.; ONISZCZUKA, A.; ONISZSZUKA, T.; WAKSMUNDZKA-HAJNOS, M.; The influence of common free radicals and antioxidants on development of Alzheimer’s Disease. Biomedicine & Pharmacotherapy, v. 78, p. 39-49, 2016.
QUEIROZ, J. E.; SANTOS, D. M.; VILA VERDE, G. M.; PEIXOTO, J. C.; PAULA, J. R.; AQUINO, G. L. B. Application of microwave-assisted extraction to the fast extraction of plant phenolic compounds in Lafoensia pacari A. St-Hil. Journal of science, 5, 12, 1366-1373, 2015.
RAJENDRA, P.; NANDAKUMAR, N.; RENGARAJAN, T.; PALANISWAMI, R.; GNANADHAS, E. N.; LAKSHMINARASAIAH, U.; GOPAS, J.; NISHIGAKI, I. Antioxidants and human diseases. Clinica Chimica Acta, v. 436, p.332–347, 2014.
SANTAGADA, V.; PERISSUTTI, E.; CALIENDO, G. The Application of Microwave Irradiation as New Convenient Synthetic Procedure in Drug Discovery. Current Medicinal Chemistry, 9, 1251-1283 1251, 2002.
SHEN, Z.-L.; JI, S.-J.; WANG, S.-Y.; ZENG, X.-F. A novel base-promoted synthesis of b-indolylketones via a three-component condensation under ultrasonic irradiation. Tetrahedron, 61, 10552–10558, 2005.
SIVAKUMAR, P. M.; PRABHAKAR, P. K.; DOBLE, P. K. Synthesis, antioxidant evaluation, and quantitative structure–activity relationship studies of chalcones. Medical Chemistry Research, v. 20, p. 482–492, 2011.
TAJAMMAL, A.; BATOOL, M.; RAMZAN, A.; SAMRA, M. M.; MAHNOOR, I.; VERPOORT, F.; IRFAN, A.; AL SEHEMI, A. G.; MUNAWAR, M. A.; BASRA, M. A. R. Synthesis, antihyperglycemic activity and computational studies of antioxidant chalcones and flavanones derived from 2,5 dihydroxyacetophenone. Journal of Molecular Structure, v. 1148, n.3, p. 512-520, 2017.
XU, R.; DING, J. C.; CHEN, X. A.; LIU, M. C.; WU, H. Y. Gallium trichloride-catalyzed conjugate addition of indole and pyrrole to a, b-unsaturated ketones in aqueous media. Chinese Chemical Letters, v. 20, p. 676-679, 2009.
YARAGORLA, S.; KUMAR, S. A facile method for the synthesis of various 3-substituted indoles via Michael addition reaction using NbCl5. Indian Journal of Chemistry, v. 54B, p. 240-244, 2015.
YU, C.; LIU, C. Conjugate Addition of Indoles to α,β-Unsaturated Ketones Using a Brønsted Acid Ionic Liquid as an Efficient Catalyst. Molecules, 14, 9, 3222-3228, 2009.
ZENG, X.-F.; JI, S.-J.; SHEN, S.-S. Conjugate Addition of Indoles to α,β-Unsaturated Ketones (Chalcones) Catalyzed by KHSO4 under Ultrasonic Conditions. Chinese Journal of Chemistry, 25, 1777—1780, 2007.
ZHANG, X.; WANG, Z.; FAN, X.; WANG, J. Synthesis of Ketones through Microwave Irradiation Promoted Metal-Free Alkylation of Aldehydes by Activation of C(sp3)–H Bond. J. Org. Chem., 80, 21, 10660–10667, 2015.











