Síntese e atividade citotóxica antitumoral de novas chalconas derivadas da 2-hidróxi-3,4,6-trimetoxiacetofenona isolada de Croton anisodontus
ISBN 978-85-85905-23-1
Área
Química Orgânica
Autores
Teixeira da Silva, P. (UVA) ; Silva dos Santos, H. (UVA) ; Nogueira Bandeira, P. (UVA) ; Costa da S. de Carvalho, M. (UFC) ; Pessoa, C. (UFC) ; W. A. Barros-nepomuceno, F. (UNILAB) ; Helena Soares Rodrigues, T. (UVA) ; Moreira Frota, V. (UVA)
Resumo
Oito chalconas foram sintetizados a partir da 2-hidróxi-3,4,6-trimetoxiacetofenona isolada de Croton anisodontus. A atividade citotóxica das chalconas foram avaliadas em linhagens celulares de câncer humano (HCT-116 (cólon) e PC-3 (próstata). As chalconas foram sintetizadas pela reação de condensação Aldol Claisen-Schimdt e identificadas por RMN de 1H e 13C. O Teste do MTT foi utilizado para determinar a citotoxicidade dos compostos sintetizados em células HCT-116 e PC-3 após 72h de incubação. Os resultados mostraram que o % RVC (percentual de redução da viabilidade celular) variou de 19,43 ± 2,19 a 75,51 ± 4,53%. A chalcona (E)-3-(4-fluorofenil)-1-(2-hidróxi-3,4,6-trimetoxifenil)prop-2-en-1-ona (4) demonstrou elevada atividade citotóxica em células HCT-116 com % RVC = 75,51 ± 4,53.
Palavras chaves
Chalconas; citotoxidade; câncer
Introdução
Chalconas constituem uma família de pequenas moléculas com abundância natural em plantas. Seus representantes são cetonas α, β-insaturadas que apresentam em sua estrutura o núcleo 1,3-diarilprop-2-en-1-ona (ÁVILA et al., 2008) e o esqueleto C6-C3-C6. Seus dois estereoisômeros, Z e E, são precursores comuns na biossíntese de flavonóides e isoflavonóides. Chalconas e seus derivados tem despertado grande interesse dos pesquisadores na área de química medicinal, sobretudo, por possuírem estrutura química relativamente simples e ampla diversidade de atividade farmacológica (DIMMOCK et al., 1999; NI et al., 2004; NOWAKOWSKA, 2007). A literatura já tem indicado o potencial antitumoral de inúmeras chalconas descrevendo sua atividade citotóxica em linhagens tumorais (BOUMENDJEL et al., 2008). O objetivo do presente trabalho foi sintetizar novas chalconas a partir da acetofenona 2-hidróxi-3,4,6-trimetoxiacetofenona previamente isolada de Croton anisodontus e, em seguida, determinar a atividade citotóxica das chalconas obtidas em 2 linhagens celulares de câncer humano ((HCT-116, cólon; e PC-3, próstata).
Material e métodos
As chalconas foram sintetizadas por reações de condensação aldólica de Claisen-Schmidt em meio básico, utilizando a 4-hidróxi-3,4,6-trimetoxiacetofenona com derivados do benzaldeído. Foi utilizado 2 mmol dos derivados do benzaldeído, dissolvidos em 5 mL de etanol. Acrescentou-se 10 gotas de uma solução de hidróxido de sódio 50% deixando-se sob agitação por 2 minutos. Acrescentou-se a esta mistura 2 mmol da acetofenona dissolvidos em 5 mL de etanol sob agitação magnética a temperatura ambiente por um período que variou de 48 horas e monitorada em CCD. Após terminada a reação o precipitado foi filtrado e lavado com H2O gelada até pH neutro. O produto formado foi avaliado em CCD e purificado por recristalização em etanol. Os espectros de RMN foram obtidos utilizando-se Espectrômetros de Bruker, modelo, Avance DPX – 300 e DRX-500 que operam na frequência de 300 MHz e 500 MHz para hidrogênio, 75 MHz e 125 MHz para carbono. Os espectros de infravermelho foram obtidos no espectrômetro Perkin-Elmer, modelo 1000-FT. Os espectros de massas foram obtidos em CG-EM QP201 da SHIMADZU. A citotoxicidade das chalconas foi determinada pelo Teste do MTT (MOSMANN, 1983). As células neoplásicas foram plaqueadas em placas de 96 poços (0,7 x 105 células/mL) e as chalconas (10 µM) foram adicionadas após 24 h. Em seguida, as placas foram incubadas por 72 h em estufa a 5 % de CO2 e 37 oC e as absorbâncias foram obtidas com o auxílio de um espectrofotômetro de placa a 595 nm. O percentual de redução de viabilidade celular (% RVC) foi determinado com base no controle negativo (DMSO 0,5 %) com o auxílio do Programa Estatístico GraphPad Prism (versão 5.0).
Resultado e discussão
Nos espectros de 1H RMN das chalconas sintetizadas foi observado os sinais entre 13,94-13,99 ppm referente aos deslocamentos químicos dos hidrogênios de cada grupo OH, e outros três sinais entre 3,84-3,96 ppm, 3,96-3,97 ppm e 3,84-3,98 ppm referentes aos hidrogênios de grupos metóxi MeO-3, MeO-4 e MeO-6, respectivamente. Entre 7,75-7,94 ppm (J= 15,6 Hz) foram atribuídos a dubletos referentes aos hidrogênios α,β insaturados, cuja constante de acoplamento (J) confirma a estereoquímica E da dupla ligação. Os singletos observados entre 6,01-6,07 referem-se ao hidrogênio ligado ao carbono 5´ do anel A. Para o anel B da chalcona 1 foi observado três sinais entre 7,42-7,60, sendo um dubleto de dubleto referente aos hidrogênios equivalentes 2/6 e dois multipletos referentes aos hidrogênios equivalentes 3/5 e hidrogênio 4. Para o anel B das chalconas 2 e 3 foi observado dois dubletos entre 7,38-7,65 ppm referentes aos hidrogênios equivalentes 2/6 e 3/5. Para o anel B da chalcona 4 foi observado quatro sinais, sendo um singleto em 8,45 referente ao H-2, um dubleto em 7,59 corresponde ao H-5 e os dubletos em 8,22 (d, J = 8,13 Hz) e 7,86 (d, J = 7,60 Hz) são referentes aos H-4 e H-6, respectivamente.No espectro de RMN 13 C das chalconas sintetizadas foi possível observar um sinal referente a carbonila α,β insaturada entre 192,7 e 193,5 ppm. A cetona absorve em 203,8 ppm, porém, a presença da insaturação α,β causa um deslocamento para campo alto e a causa provável é a deslocalização de carga pelo anel benzênico ou pela ligação dupla que torna o carbono da carbonila menos deficiente de elétrons. Os carbonos olefínicos α e β são observados entre 127,4 a 142,8 ppm, respectivamente. Os sinais entre 56,2-60,90 são referentes aos carbonos dos grupos metóxi (Tabela 1). A tabela 2 mostra o % RVC das chalconas investigados cujos dados foram utilizados para uma análise preliminar de relação estrutura-atividade. Os resultados mostraram que o % RVC variou de 19,43 ± 2,19 a 75,51 ± 4,53%, revelando que pequenas modificações na estrutura química das chalconas foram capazes de alterar a atividade biológica. A análise cuidadosa dos dados de citotoxicidade obtidos revelou que a chalcona (E)-3-(4-fluorofenil)-1-(2-hidróxi-3,4,6-trimetoxifenil)prop-2-en-1-ona (4) demonstrou a atividade mais forte contra as células HCT-116 (% RVC = 75,51 ± 4,53). O forte efeito citotóxico da chalcona 4 pode ser atribuído ao efeito combinado da presença no anel A de grupos metóxi e hidróxi doadores de elétrons e do átomo de flúor retirado de elétrons presente na posição para do anel B. A presença de um sistema conjugado prolongado reduz o efeito citotóxico, o qual pode ser observado pela comparação entre os compostos 1 (% RVC = 54,10 ± 6,17) e 7 (% RVC = 41,08 ± 1,20). Outra característica estrutural importante que promoveu o aumento da atividade citotóxica foi a presença de grupos de retirada eletrônica no anel B e a substituição do anel B por uma parte heterocíclica dos compostos demonstrada pela atividade moderada das chalconas 2 (% RVC = 44,83 ± 0,72) , 3 (% RVC = 47,76 ± 5,11), 5 (% RVC = 62,94 ± 2,35) e 6 (% RVC = 57,26 ± 0,67). Por outro lado, a presença de grupos metóxi doadores de elétrons no anel B promoveu a redução da atividade citotóxica demonstrada pela fraca atividade do composto 8 (% RVC = 19,43 ± 2,19).
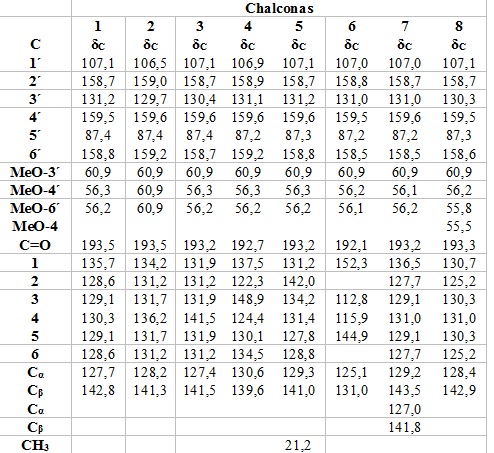
Dados de RMN de 13C (75 MHz) das chalconas sintetizadas
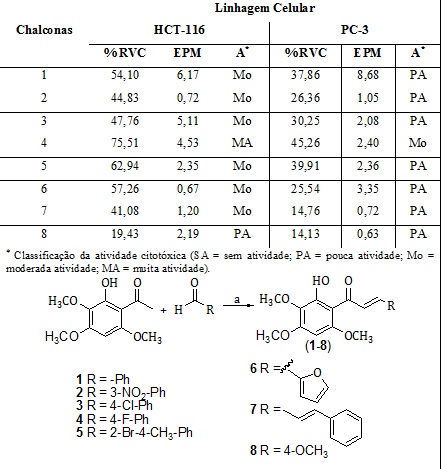
Avaliação citotóxica de derivados de chalconas (1-8) (10 µM) em linhagens celulares de câncer humano.
Conclusões
Em relação à atividade citotóxica, este trabalho demonstrou que pequenas alterações na estrutura das chalconas podem melhorar a atividade antitumoral in vitro das chalconas. Neste contexto, a chalcona (E)-3-(4-fluorofenil)-1-(2-hidróxi-3,4,6-trimetoxifenil)prop-2-en-1-ona (4) (contendo os grupos metóxi e hidróxi no anel A e um átomo de flúor no anel B) apresentou forte atividade citotóxica em células tumorais humana, em especial em células HCT-116, dando-nos a perspectiva de realização de futuros estudos sobre o mecanismo de ação usando ensaios in vitro e in vivo.
Agradecimentos
Os autores agradecem ao CENAUREM pela obtenção dos espectros de RMN. Os autores, também, agradecem ao Instituto Nacional do Câncer (Bethesda, MD, EUA) por doar as linhage
Referências
BOUMENDJEL A, BOCCARD J, CARRUPT PA, NICOLLE E, BLANC M, GEZE A, et al. Antimitotic and antiproliferative activities of chalcones: Forward structure-activity relationship. J Med Chem 2008; 51: 2307-10.
DIMMOCK, J.R.; ELIAS, D.W.; BENAZELY, M.A.; KANDEPU, N.M. Bioactivities of chalconas. Current Medicinal Chemistry, v. 6 (12), p. 1125 – 11249, 1999.
MOSMANN, T. 1983. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J.Immunol. Methods, v.65, p 55-63.
NI, L.; MENG, C.Q.; SIKOKSKI, J.A. Recent advances in therapeutic chalcones. Expert Opinion on Therapeutic Patents, v. 14(12), p. 1669 – 1691, 2004.
NOWAKOWSKA, Z.A. A review of anti-inflammatory chalcones. European Journal of Chemistry, v. 42, p. 125 – 137, 2007.











