Estudo da interação entre o antioxidante natural Quercetina e a proteína envolvida na Doença de Parkinson alfa-sinucleína.
ISBN 978-85-85905-23-1
Área
Bioquímica e Biotecnologia
Autores
Torres do Nascimento, L.P. (IFRJ) ; Lopes da Silva, Y. (IFRJ) ; Coelho Cerqueira, E. (IFRJ)
Resumo
A doença de Parkinson (PD) é uma desordem neurodegenerativa que causa o comprometimento do sistema motor devido à perda de neurônios na região da substantia nigra do cérebro. Outra característica marcante da doença é a presença de agregados fibrilares da proteína pré-sináptica α-sinucleína (aS) na mesma região. Intermediários do processo de agregação da aS, conhecidos como protofibras podem ser tóxicos e induzir morte neuronal na PD. Pequenas moléculas contendo o grupo catecol, como o aldeído DOPAL, induzem a formação de oligômeros covalentes de aS potencialmente tóxicos. A quercetina (QCT) é um flavonol antioxidantes que possui o grupo catecol em sua estrutura. Foi mostrado neste trabalho que QCT induz a oligomerização da aS e é capaz de realizar ligações fortes com monômeros da proteína.
Palavras chaves
alfa-sinucleína; Quercetina; Doença de Parkinson
Introdução
A Doença de Parkinson (PD) é um distúrbio neurodegenerativo que causa um comprometimento do sistema motor devido à perda de neurônios dopaminérgicos na região da substantia nigra do cérebro. Nesta mesma região, em pacientes de PD, são encontrados agregados fibrilares da proteína α-sinucleína (aS) [1]. A aS é uma proteína desenovelada que apresenta diversos estados de agregação, desde pequenos agregados pré-fibrilares (protofibras), até estruturas fibrilares estáveis e ordenadas[2]. Protofibras são oligômeros intermediários da agregação da aS que induzem permeabilização de membranas, levando à morte celular, enquanto que fibras são inertes[2]. É conhecido que compostos com o grupo funcional catecol (orto- dihidróxibenzeno) sofrem oxidação em meio aquoso à orto-quinonas e são capazes induzir a formação de oligômeros potencialmente tóxicos. Exemplos destes compostos são a dopamina e seu metabólito 3,4- dihidróxifenilacetaldeído (DOPAL)[3]. Flavonóis são polifenols naturais conhecidos por apresentarem efeitos protetores em doenças neurodegenerativas devido à ação antioxidante. Alguns flavonóis possuem o grupo catecol em sua estrutura, como é o caso da quercetina (QCT), presente no fármaco Ginkgo biloba, que pode levar à melhoria de sintomas de pacientes da Doença de Alzheimer[4]. A QCT também é encontrada em maçãs, cebolas, chás e vegetais verdes. O efeito antioxidante da QCT poderia proteger a aS da oligomerização mediada por catecois, como o DOPAL. Entretanto, a QCT possui o grupo catecol, podendo também, por si só, induzir a oligomerização da aS. Neste trabalho, será investigado o efeito da QCT como antioxidante e como inibidor ou estimulador da oligomerização da aS na ausência ou presença do indutor da oligomerização da aS, DOPAL, e do antioxidante glutationa (GSH).
Material e métodos
Expressão e purificação da aS: Bactérias E. coli transformadas com plasmídeo para produção de aS humana foram inoculadas em LB líquido contendo ampicilina e cloranfenicol e incubadas a 37 ºC até absorvância de 0,7 em 600 nm. Foi feita a indução da produção de proteína com IPTG. As bactérias foram rompidas com ultrassom de ponta e o sobrenadante recebeu HCl até pH 3,5 para precipitação ácida das proteínas. A aS permanece no sobrenadante onde realizou-se sua precipitação com sulfato de amônio. O precipitado de aS foi dissolvido e dialisado contra Tris 20 mM pH 8,0, seguido de água Milli-Q. A aS foi liofilizada e armazenada a -20 ºC. A caracterização da aS foi feita por eletroforese em gel de poliacrilamida/SDS (SDS-PAGE) e cromatografia de exclusão molecular (SEC) (Superdex 200 10/300GL, GE Healhcare). Incubação da aS com QCT: A aS em uma concentração de 50 μM foi incubada na ausência ou presença de QCT 0,5 mM, DOPAL 0,5 mM e/ou GSH 5 mM por 20 horas a 37 ºC, 500 rpm, em tampão fosfato de sódio 20 mM pH 7,5. Avaliação da oxidação da QCT: Ao se oxidar, a solução amarela de QCT adquire coloração alaranjada acompanhada pelo surgimento de uma banda de absorção na região do visível, com absorvância máxima em 475 nm que foi utilizada para monitorar a oxidação da QCT no tempo utilizando espectrofotômetro. Avaliação da oligomerização da aS: O estado oligomérico da aS foi avaliado por SEC e por SDS-PAGE. Para SEC, foram injetados 50 μL da proteína a 50 μM que foi eluída com fase móvel de tampão fosfato de sódio 20 mM, NaCl 150 mM em pH 7,5. A absorvância foi monitorada em 215 nm (ligação peptídica) e 475 nm (QCT oxidada). Para o SDS- PAGE, foram aplicados 30 μL da proteína a 50 μM em gel com 17 % de acrilamida. Por fim, o gel foi revelado com prata.
Resultado e discussão
A aS foi expressada e caracterizada com sucesso, sendo obtidos 52 mg da
proteína pura e liofilizada com uma banda única no SDS-PAGE revelado por
prata em 17 kDa e um pico único no cromatograma de SEC em 13,9 mL,
resultados concordantes com o esperado para a aS monomérica pura.
Foi mostrado por SEC que a incubação da aS com QCT nas condições citadas
mantém a proteína majoritariamente na forma monométrica (M), que elui em
13,9 mL. Porém, uma pequena porção da proteína (6,8 %) é convertida a 3
tipos de oligômeros classificados como O1 (12,1 mL, 1,3 %), O2 (8,2 mL, 4,4
%) e O3 (6,1 mL, 1,1 %) (Figura 1). Em SEC, quanto menor o volume de
eluição, maior o tamanho da molécula, indicando que M < O1 < O2 < O3. Os
oligômeros O1 aparecem no mesmo volume de eluição de dímeros de aS formados
na presença de DOPAL[3], sugerindo que O1 sejam dímeros de aS.
Na ausência de QCT, apenas 1,0 % da proteína encontrou-se na forma de
oligômeros do tipo O2 (0,5 %) e O3 (0,5%). Foi observado pela absorvância em
475 nm que o antioxidante GSH foi capaz de inibir completamente a oxidação
da QCT. Esta inibição gerou uma queda considerável na formação de oligômeros
de aS na presença de QCT e GSH para 2,3 % (0,0 % de O1, 1,5 % de O2 e 0,8 %
de O3), sugerindo que a oxidação da QCT é essencial na interação com aS e na
formação de oligômeros induzidos por QCT.
Devido à baixa população de oligômeros, não foi possível detectá-los por
SDS-PAGE, embora tenha sido notado um arraste na banda do monômero de aS que
desaparece na presença de GSH (Figura 2). Isto é concordante com o fato do
pico da aS monomérica em 13,9 mL apresentar absorvância em 475 nm, o que não
ocorre na ausência de QCT e na presença de QCT+GSH. Uma interação forte,
possivelmente covalente, entre QCT oxidada e aS explicaria esses dados.
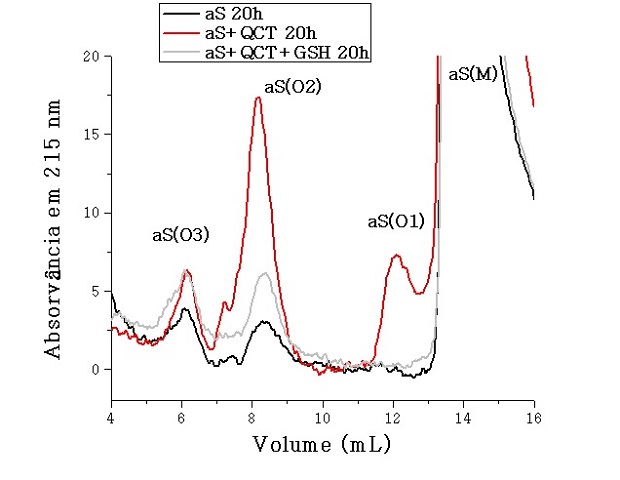
Cromatogramas obtidos por SEC de amostras de aS 50 μM na ausência ou presença de QCT 0,5 mM e GSH 5 mM após incubação de 20 horas a 37 ºC.
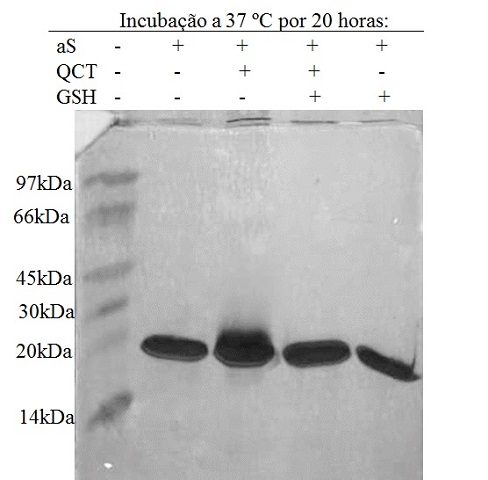
Gel de SDS-PAGE de amostras de aS 50 μM incubadas na ausência ou presença de QCT 0,5 mM e GSH 5 mM. A primeira coluna contém padrões de peso molecular
Conclusões
A partir dos resultados foi possível concluir que a QCT induz a formação de uma pequena quantidade de oligômeros de aS e que é capaz de se ligar através de interações fortes com a aS monomérica. Os experimentos para avaliar o efeito da QCT na oligomerização da aS na presença de DOPAL, de forma a verificar se ocorre uma proteção ou estímulo da formação de agregados, estão em andamento. Espera-se que os resultados obtidos possibilitem a obtenção de conclusões a respeito do efeito na PD de antioxidantes naturais que contém o grupo catecol em sua estrutura como a QCT.
Agradecimentos
Ao Instituto Federal de Educação, Ciência e Tecnologia do Rio de Janeiro (IFRJ) e ao professor Cristian Follmer (IQ-UFRJ) pelo espaço e auxílio para realização de par
Referências
[1] SPILLANTINI M.G.; CROWTHER, R. A.; JAKES, R.; HASEGAWA, M.; GOEDERT, M. Synuclein in filamentous inclusions of Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. Proc Natl Acad Sci USA,v. 95, p. 6469–6473,1998.
[2] VOLLES M. J.; LANSBURY P. T.; Zeroing in on the Pathogenic Form of -synuclein and its Mechanism of Neurotoxicity in Parkinson’s Disease. Biochemistry, v. 42, p. 7871-7878, 2003.
[3] FOLLMER, C.; COELHO-CERQUEIRA, E.; YATABE-FRANCO, D. Y.; ARAUJO, G. D. T.; PINHEIRO, A. S.; DOMONT, G. B.; ELIEZER, D. Oligomerization and membrane binding properties of covalent adducts formed by the interaction of α-synuclein with the toxic dopamine metabolite 3,4-dihydroxyphenylacetaldehyde (DOPAL). J. Biol. Chem., v. 290, no. 46, p. 27660-27679, 2015.
[4] ZHU, M.; HAN, S.; FINK, A. L. Oxidized quercetin inhibits α-synuclein fibrillization. Biochim. Biophys. Acta., v. 1830, no. 4, p. 2872-2881, 2013.











