Investigação Estrutural e Térmica no Material Conjugado Hidrotalcita-Hidroxiapatita
ISBN 978-85-85905-23-1
Área
Materiais
Autores
Hisano, C. (UEMS - UNIDADE UNIVERSITÁRIA DE NAVIRAÍ) ; Kawahara, C.K.C. (UEMS - UNIDADE UNIVERSITÁRIA DE NAVIRAÍ) ; Barbosa, G.V. (UEMS - UNIDADE UNIVERSITÁRIA DE NAVIRAÍ) ; Amoresi, R.A.C. (UNESP) ; Zaghete, M.A. (UNESP) ; Santos, S.L. (UFMS) ; Oliveira, L.C.S. (UFMS) ; Cavalheiro, A.A. (UEMS - UNIDADE UNIVERSITÁRIA DE NAVIRAÍ)
Resumo
As estruturas da hidrotalcita e hidroxiapatita podem se organizar com simetria trigonal e permitir a conjugação de fases em um novo e diferente material, permitindo aperfeiçoar a capacidade de adsorção para aplicações ambientais. Foi utilizado o conceito de modelagem química para obter a conjugação de fases, com o íon fosfato servindo como espécie comum nas duas fases e permitindo a obtenção de um material conjugado em nanoescala. Foi possível demonstrar por DRX, FTIR e TG que o material conjugado difere de materiais análogos produzidos anteriormente, pois o material conjugado obtido neste trabalho possui diferenças marcantes de cristalinidade, espaçamento cristalino, energia de vibração dos grupos fosfato e um comportamento térmico bem distinto dos materiais obtidos em sua forma isolada.
Palavras chaves
Estrutura HDL; Fosfato; Interação química
Introdução
As argilas aniônicas são hidróxidos duplos lamelares (HDL) cuja estabilidade estrutural e capacidade de adsorção derivam da presença de cátions trivalentes de alumínio como substituintes do cátion de magnésio, criando um excesso de cargas positivas nas lamelas, que permite a incorporação de espécies aniônicas no espaço interlamelar através de interações coulômbicas. O ânion interlamelar mais comum em hidrotalcitas naturais é o carbonato, devido a sua abundância em águas naturais e sua estabilidade com cátions de metais alcalinos terrosos, ocorrendo naturalmente e recebendo o nome mineralógico de Hidrotalcita (MIYATA, 1980; CAVANI et al., 1991; VIEILLARD, 2000; GU et al., 2015). As hidrotalcitas podem ser sintetizadas alterando cátions metálicos e também o ânion intercalar, visando alterar algumas características importantes no material. Deste modo, a inserção de ânions fosfato, por exemplo, podem aumentar a estabilidade térmica das hidrotalcitas e possibilitar conjugações com outros materiais adsorventes para diversas aplicações, como adsorvente de poluentes orgânicos ou matrizes de liberação controlada de herbicidas ou reguladores de crescimento de plantas (KHAN & O'HARE, 2002; KOUTSOPOULOS, 2002; TICHIT & COQ, 2003; LV et al., 2004; FERREIRA et al., 2006; CARDOSO et al.; 2006). A conjugação da hidrotalcita com outros minerais depende dos sistemas cristalinos de cada fase individual, que devem possuir alguma sinergia. Assim, o sistema romboédrico da hidrotalcita pode ser associado ao sistema hexagonal, por exemplo, como presente na hidroxiapatita (ROY et al., 1953; BRAVO-SUÁREZ et al., 2004. WIYANTOKOA et al., 2015). Assim, foi investigada neste trabalho a sinergia estrutural do material conjugado Hidrotalcita-Hidroxiapatita, tendo o ânion fosfato como espécie comum.
Material e métodos
A primeira tentativa de conjugar as estruturas da hidrotalcita e hidroxiapatita em um só material foi feita por Rivera e colaboradores (2009), obtendo inúmeras combinações destes dois materiais, mas sempre como uma mistura de fases não conjugadas, onde a hidroxiapatita se apresentava sempre com grande cristalinidade e a hidrotalcita, praticamente amorfa. As causas para os resultados insatisfatórios de Rivera e colaboradores podem estar relacionadas à espécie aniônica interlamelar e a forma de obtenção, o que motivou o presente trabalho. A metodologia investigada aqui inclui não somente a mistura dos dois materiais, mas a modelagem química da estrutura híbrida, formulando composições que permitam que os íons fosfato da hidroxiapatita sejam também as espécies interlamelares da hidroxiapatita (OLSON, 2000; LE & WINKLER, 2016). Assim, para a compreensão dos resultados, o material conjugado hidrotalcita- hidroxiapatita (HTA - Ca3/2Mg0,7Al0,3(OH)1,7(PO4)0,3) foi comparado a duas amostras padrão, uma de hidrotalcita fosfatada (HTF - Mg0,7Al0,3(OH)2(PO4)0,1) e outra de hidroxiapatita (HA - Ca5(PO4)3OH). Foram utilizados nitratos de magnésio, alumínio e cálcio, como precursores dos cátions metálicos e dihidrogenofosfato de sódio, como precursor do fosfato. Após a precipitação das amostras usando hidróxido de sódio como fonte de hidroxila e também para ajuste de pH, elas foram digeridas a 60 ºC por 6 h e decantadas em temperatura ambiente por 18 h. Todas as amostras foram então filtradas a vácuo e submetidas a doze ciclos de lavagem com água destilada, de modo que o filtrado apresentasse condutividade constante e próxima da água destilada usada no processo. Finalmente, as amostras foram secas em estufa a 100ºC por 24 h, levemente desaglomeradas e caracterizadas por DRX, FTIR e TG.
Resultado e discussão
Na Fig. 1 são mostrados os padrões DRX e espectros FTIR e se observa que a
amostra padrão HA possui fase única HA hexagonal P63/m, com altíssima
cristalinidade (picos estreitos), enquanto a amostra padrão HTF tem baixa
cristalinidade (picos largos), mas também fase única romboédrica R-3m (HDL).
Já a amostra do material conjugado HTA apresenta picos das duas fases, mas com
cristalinidade semelhante, observada principalmente pela diferença de largura
do pico HA(211) em 31,8 (2-teta) entre as amostra HA e HTA. Além disso, a
posição deste pico está deslocada para 31,1 (2-teta) na amostra HTA, indicando
haver alteração estrutural da hidroxiapatita no material conjugado.
Nos espectros FTIR observa-se que a amostra HTA possui banda da estrutura HDL
(VII), similar a amostra HTF. A banda de vibração do grupo fosfato (banda V)
na amostra HTA é deslocada para número de onda maior (1030 cm-1) em relação à
amostra HA (1020 cm-1), mostrando que alterações na coordenação do grupo
fosfato. Há uma pequena banda de carbonato (III) observada nos espectros das
estruturas HDL (HTF e HTA), provavelmente incorporada pela água destilada
usada no processo de lavagem.
Na Fig. 2 observam-se as curvas termogravimétricas (TG/DTG) para as três
amostras. Diferente da amostra HA, as amostras com estrutura HDL (HTF e HTA)
possuem perdas de massa associadas à desidratação superficial (perda I) e
interlamelar (perda II). A perda de massa III se refere à desidroxilação das
lamelas, ocorrendo em 350 ºC para amostra HTA, bem abaixo da verificada para a
amostra HTA (430 ºC). Isto mostra que o material conjugado tem um
comportamento térmico bem distinto, corroborando as diferenças de
cristalinidade, posições dos picos DRX e bandas FTIR e confirmando a interação
estrutural entre hidrotalcita e hidroxiapatita.
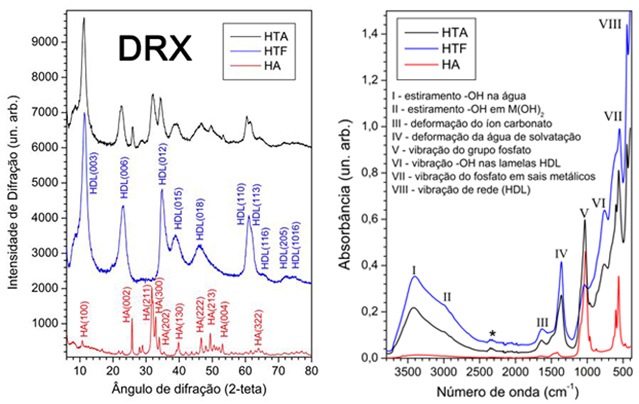
Padrões DRX e espectroscopia FTIR das amostras secas 100ºC por 24h: Hidrotalcita-Hidroxiapatita (HTA), Hidrotalcita Fosfata (HTF) e Hidroxiapatita(HA)
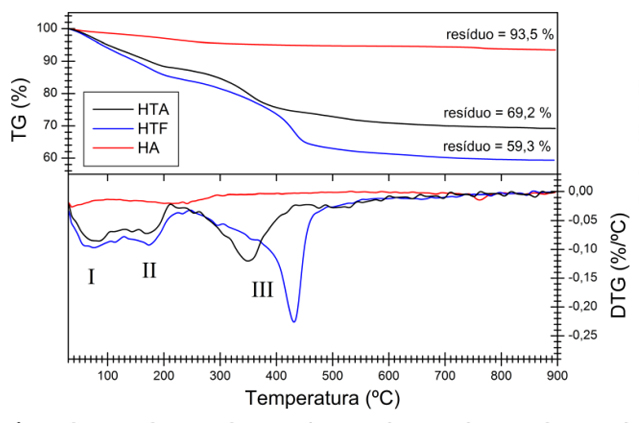
Análise Termogravimétrica (TG/DTG) das amostras secas 100ºC por 24h: Hidrotalcita-Hidroxiapatita (HTA), Hidrotalcita Fosfata (HTF) e Hidroxiapatita(HA
Conclusões
Neste trabalho, o material conjugado hidrotalcita-hidroxiapatita foi obtido com sucesso, mostrando que a modelagem química e estrutural é passo importante para síntese de materiais nanoestruturados. Como forma de aperfeiçoar a pureza do material conjugado, pode-se aumentar a quantidade de fosfato, evitando que o ânion carbonato ocupe espaços interlamelares durante a lavagem. De qualquer modo, foi possível demonstrar por DRX, FTIR e TG que o material conjugado difere de materiais análogos, pois o material obtido neste trabalho não apresentava mistura de fases independentes entre si.
Agradecimentos
Os autores agradecem a PIBAP-UEMS, FUNDECT, CNPq, CAPES e FINEP pelas bolsas concedidas e apoio financeiro.
Referências
BRAVO-SUÁREZ, J.J.; MOZO, E.A.P.; OYAMA, S.T. Review of the synthesis of layered double hydroxides: a thermodynamic approach. Química Nova, v. 27, n. 4, p. 601-14, 2004.
CARDOSO, L. P.; CELIS, R.; CORNEJO, J.; VALIM, J. B. Layered double hydroxides as supports for the slow release of acid herbicides. Journal of Agricultural and Food Chemistry, v. 54, n. 16, p. 5968-5975, 2006.
CAVANI, F.; TRIFIRÓ, F.; VACCARI, A. Hydrotalcite Type anionic clays: Preparation, properties and applications. Catalysis Today, v. 11, p. 177-301, 1991.
FERREIRA, O. P.; MORAES, S.; DURÁN, N.; CORNEJO, L.; ALVES, O. Evaluation of boron removal from water by hydrotalcite-like compounds. Chemosphere, v. 62, p. 80-88, 2006.
GU, Z.; ATHERTON, J. J.; XU, Z. P. Hierarchical layered double hydroxide nanocomposites: structure, synthesis and applications. Chemical Communications, v. 51, n. 15, p. 3024-3036, 2015.
KHAN, A. I.; O'HARE, D. Intercalation chemistry of layered double hydroxides: recent developments and applications. Journal of Materials Chemistry, v. 12, p. 3191-3198, 2002.
KOUTSOPOULOS, S. Synthesis and characterization of hydroxyapatite crystals: a review study on the analytical methods. Journal of Biomedical Materials Research, v. 15, n. 62, p. 600-612, 2002.
LE, T.C.; WINKLER, D.A. Discovery and Optimization of Materials Using Evolutionary Approaches. Chem. Rev., v. 116, n. 10, p. 6107-6132, 2016.
LV, J.; QIU, L. Z.; QU, B. J. Controlled synthesis of magnesium hydroxide nanoparticles with different morphological structures and related properties in flame retardant ethylene-vinyl acetate blends. Nanotechnology. V. 15, n. 11, p. 1576-1581, 2004.
MIYATA, S. Physico-Chemical Properties of Synthetic Hydrotalcites in Relation to Composition. Clays and Clay Minerals. V. 28, n.1, p. 50-56, 1980.
OLSON, G.B. Designing a New Material World. Science V. 288, n.12, p. 993-998, 2000.
RIVERA, J. A.; FETTER, G.; BAÑOS L.; GUZMÁN J.; Bosch, P. New hydroxyapatite-hydrotalcite composites I. synthesis. J. Porous Mater. V. 16, p. 401-408, 2009.
ROY, D.M.; ROY, R.; OSBORN, E.F. The system MgO-A1203-H20 and influence of carbonate and nitrate ions on the phase equilibria, Am. J. Sci. v. 251, p. 337-360, 1953.
TICHIT, D.; COQ, B. Catalysis by Hydrotalcites and Related Materials. Cattech. .V. 7, n. 6, p. 206-217, 2003.
VIEILLARD, P. A. New Method For The Prediction Of Gibbs Free Energies Of Formation Of Hydrated Clay Minerals Based On The Electronegativity Scale. Clays and Clay Minerals. V. 48, n. 4, p. 459-473, 2000.
WIYANTOKOA, B.; KURNIAWATIA, P.; PURBANINGTIAS, T. E.; FATIMAH, I. Synthesis and Characterization of Hydrotalcite at Different Mg/Al Molar Ratios. Procedia Chemistry. V. 17, p. 21-26, 2015.











