AVALIAÇÃO DO USO DA FOLHA DE CASTANHOLA (Terminalia Catappa, L.) NA REMOÇÃO DOS ÍONS Cu(II) E Pb(II) EM MEIO AQUOSO.
ISBN 978-85-85905-23-1
Área
Iniciação Científica
Autores
Alves de Almeida Silva, J. (UFPA) ; Silva da Fonseca Alves, B. (UFPA) ; das Graças Fernandes Dantas, K. (UFPA) ; Helena Tavares Pinheiro, M. (UFPA)
Resumo
O presente trabalho investigou a capacidade da folha de castanhola (Terminalia catappa, L.) in natura (CIN), na remoção de íons cobre (II) e chumbo (II) de uma solução aquosa, em sistemas de batelada. O tempo necessário para que o sistema atingisse o equilíbrio para o Cu (II) foi de 60 min e de 180 min para o Pb (II), seguindo uma cinética descrita pelo modelo de pseudo- segunda ordem. As adsorções foram melhor conduzidas em pH 5, para ambos os metais. O estudo comprovou que a biomassa possui potencial para o tratamento de águas residuais contaminadas com íons cobre (II) e chumbo (II), com remoções de 86% e 96%, respectivamente.
Palavras chaves
Folha de castanhola; Remoção de íons metálicos; Adsorção
Introdução
As atividades industriais geram muitos contaminantes ao meio ambiente, dentre eles os metais pesados. Caracterizados como tóxicos, biocumulativos e não- biodegradáveis, podem causar também, danos à saúde. (PELLERA et al 2012). Dentre as contaminações, vale destacar as causadas por íons cobre (II) e chumbo (II). O excesso de cobre no organismo humano, pode provocar náusea, irritação gastrointestinal, dano hepático e renal, dano ao sistema nervoso central (WANG et al. 2016, PELLERA et al 2012, CHOWDHURY, 2011). O chumbo é cancerígeno, pode causar danos ao sistema nervoso central, rins e audição (GUNDOGDU et al. 2009). Dentre as várias técnicas de tratamento de efluentes, o uso de adsorventes alternativos de baixo custo e alta disponibilidade são cada vez mais frequentes. Nesta pespectiva, as folhas de castanhola se apresentam como boa alternativa de biossorvente, em virtude de sua abundância. Neste trabalho, o pó das folhas de castanhola foram usadas para remover os íons Cu(II) e Pb(II) de solução aquosa, bem como avaliar o efeito do pH e tempo no processo de biossorção.
Material e métodos
A amostra da folha de castanhola (Terminalia catappa, L.) foi coletada no campus da UFPA, Cidade Universitária José Silveira Netto- Belém- Pará, a qual foi triturada e separada através de análise granulométrica com auxílio de um agitador de peneiras (Bertel), sendo selecionada a faixa de 80 mesh por apresentar uma granulometria homogênea e um maior rendimento, para a condução dos ensaios. O pó da folha de castanhola foi lavado com água deionizada e filtrada em funil comum até que a água de lavagem estivesse isenta de cor e turbidez. Para o estudo do efeito de pH foram utilizadas 0,100 g do biossorvente e 20 mL de solução aquosa do íon metálico na concentração de 80 mg/L e o pH foi ajustado para valores na faixa de 2 a 8, sob agitação de 250 rpm em temperatura ambiente durante 60 e 180 min para os íons Cu(II) e Pb(II), respectivamente. Após esse período, alíquotas de cada amostra foram centrifugadas e determinada a concentração residual de cada íon por espectrometria de absorção atômica com atomização em chama (FAAS) (Ice 3300 Thermo Scientific, Reino Unido, Cambridge). Para o estudo cinético foram pesadas 42 frações de 0,1000 g do biossorvente (7 para cada metal e em triplicata) e 20 mL da solução monoelementar na concentração de 80 mg/L em temperatura ambiente e pH 5,0. As suspensões aquosas foram agitadas e alíquotas coletadas nos intervalos de tempo de 30, 60, 180, 360, 540, 720 e 1440 min, filtradas e a concentração do íon metálico determinada por FAAS.
Resultado e discussão
Os ensaios de biossorção para o pó da folha de castanhola mostraram que o
tempo necessário para que o sistema atingisse o equilíbrio foi de 60 min para
os íons Cu (II) e 180 min para os íons de Pb (II). A amostra removeu em torno
de 86 % do Cu (II) e 96% do Pb (II) presentes em solução aquosa (Figura 1)
Pôde-se observar uma maior capacidade de biossorção para os íons Cu
(II) e Pb(II) em pH 5. Resultados semelhantes encontrados por BENAISSA,
ELOUCHDI, 2011; YAO et al 2010; UCUN et al. 2008; PALIN et al 2016 e SOUZA et
al. 2017, para os mesmos íons estudados.
A partir dos ajustes dos dados experimentais, foram calculados os parâmetros
cinéticos de biossorção para os íons Cu (II) e Pb (II) segundo os modelos de
pseudo-primeira ordem e pseudo-segunda ordem, conforme apresentado na Tabela
1.
Os dados experimentais para o pó da folha de castanhola não apresentam um bom
ajuste ao modelo de pseudo-primeira ordem, para os íons Cu(II) e Pb (II),
verificado por seus coeficientes de correlação (R²). Os dados cinéticos de
adsorção foram melhor ajustados com o uso do modelo cinético de pseudo-segunda
ordem, o qual forneceu o melhor coeficiente de correlação linear (R²),
verifica-se também uma maior compatibilidade do valor experimental (qexp) com
o valor calculado (qe), indicando que é o modelo mais adequado para a
interpretação do mecanismo de adsorção de ambos os metais.
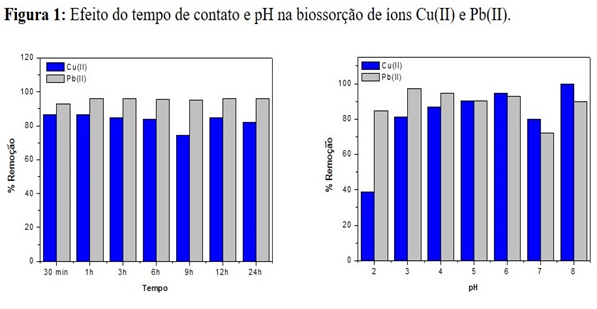
Efeito do tempo e pH na biossorção para de íons Cu(II) e Pb(II).
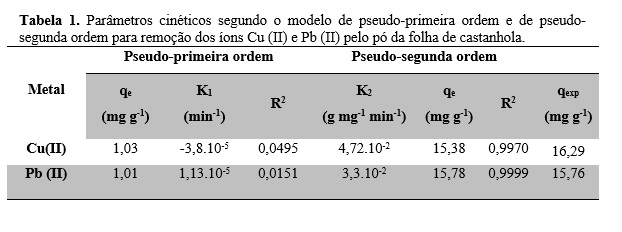
Parâmetros cinéticos de biossorção para os íons Cu(II) e Pb(II).
Conclusões
A capacidade de biossorção dos íons Cu (II) e Pb(II) é influenciada pelo pH do meio, obtendo- se a maior eficiência em pH 5,0 para ambos. O tempo de equilíbrio alcançado para a remoção de íons Cu(II) foi de 60 min e de 180 min para íons Pb(II). A cinética de adsorção foi melhor representada pelo modelo de pseudo segunda ordem. Portanto, o pó da folha da castanhola se mostrou eficiente na remoção dos íons Cu(II) e Pb(II) presentes em solução aquosa, promovendo uma remoção de 86% e 96%, respectivamente.
Agradecimentos
Ao GEAAp, a PROPESP/UFPa pela concessão da bolsa de IC(PIBIC-AF) e à Drª Bianca S. F. Alves pelo auxílio nas análises por FAAS e conhecimentos compartilhados.
Referências
BENAÏSSA, H.; ELOUCHDI, M. A. Biosorption of copper (II) ions from synthetic aqueous solutions by drying bed activated sludge. Journal of Hazardous Materials, 194, p.69–78, 2011.
CHOWDHURY, S.; SAHA, P. Biosorption kinetics, thermodynamics and isosteric heatof sorption of Cu(II) onto Tamarindus indica seed poder. Colloids and Surfaces B: Biointerfaces, 88, p.697– 705, 2011.
GUNDOGDU, A. et al. Biosorption of Pb(II) ions from aqueous solution by pine bark (Pinus brutia Ten.). Chemical Engineering Journal, 153, p.62–69, 2009.
PALIN, Jr. D. et al. Evaluation of Pb (II) biosorption utilizing sugarcane bagasse colonized by Basidiomycetes. Environmental Monitoring And Assessment, 188(5), p. 1-14, 2016.
PELLERA, F. M. et al. Adsorption of Cu(II) ions from aqueous solutions on biochars prepared from agricultural by-products. Journal of Environmental Management. Journal of Environmental Management, 96, p.35-42, 2012.
SOUZA, I. P. A. F. et al. Preparation of biosorbents from the jatoba (Hymenaea courbaril) fruit shell for removal of Pb (II) and Cd (II) from aqueous solution. Environ Monit Assess. p. 189-632, 2017.
UCUN, H.; AKSAKAL, O.; YILDIZ, E. Copper(II) and zinc(II) biosorption on Pinus sylvestris L. Journal of Hazardous Materials. V. 161, p.1040-1045, 2009.
WANG, J. Y. et al. Biosorption of copper(II) from aqueous solutions by Aspergillusniger-treated rice straw. Ecological Engineering. 95, p. 793–799, 2016.
YAO, Z. Y.; QI, J. H.; WANG, L.-H. Equilibrium, kinetic and thermodynamic studies on the biosorption of Cu(II) onto chestnut shell. Journal of Hazardous Materials, 174, p. 137–143, 2010.











