Reações de α-selenilação para a síntese de enóis éteres
ISBN 978-85-85905-23-1
Área
Iniciação Científica
Autores
Rodrigues de Souza, R. (CCET/UEG) ; Borges Costa, M. (CCET/UEG)
Resumo
Compostos carbonílicos são largamente utilizados em diversas sínteses orgânicas por possuírem uma alta reatividade, nos átomos de hidrogênios dos carbonos α, e relativa estabilidade ao formar enolatos, tornando-se bons nucleófilos em reações. Já os compostos carbonílicos α-selenilados possuem uma grande importância na síntese orgânica devido a facilidade com a qual são convertidos em compostos sinteticamente úteis como compostos carbonílicos α,β-insaturados, arizidinas terminais, éster-α-hidróxilado, aminas alílicas e α-aminoácidos. Neste contexto, nosso grupo de pesquisa vem desenvolvendo estudos com a aplicação de metodologias sintéticas que envolvam reações de alfa-selenilação de dicetonas, para a produção de enóis éteres que são precursores bastante úteis na síntese de fármacos.
Palavras chaves
Síntese; Selenilação; Enol éter
Introdução
Nos últimos anos, o interesse pela síntese de compostos orgânicos de selênio aumentou consideravelmente devido as propriedades biológicas que muitos destes compostos apresentam, tais como, antioxidantes (BRENNEISEN et al., 2005), antitumoral, antimicrobianos e antivirais (POSSER, 2009). O impacto da química dos compostos orgânicos selenilados na química orgânica moderna é visível. Uma vez que um átomo de selênio ao incorporar-se a um substrato o mesmo pode ser removido facilmente via eliminação “syn” do selenóxido ou um rearranjo sigmatrópico do tipo [2,3]. Além disso, a ligação carbono-selênio pode ser substituída por ligações carbono-hidrogênio, carbono-halogênio, carbono-lítio e carbono-carbono. Assim, geralmente espécies de organosselênios podem ser inseridas eficientemente, manipuladas e removidas de várias formassob condições reacionais leves (NAZARI & MOVASSAGH, 2009). Compostos carbonílicos α-selenilados possuem uma grande importância na síntese orgânica devido a facilidade com a qual são convertidos em compostos sinteticamente úteis como compostos carbonílicos α,β-insaturados, arizidinas terminais, éster-α-hidróxilado, aminas alílicas e α-aminoácidos (VICTORIA, 2010). Enóis éteres são moléculas orgânicas que possuem o átomo de oxigênio ligado a uma ligação dupla (MILATA, 2008). São compostos que possui atividade biológica dentre elas estão: atividade antimicrobiana, antifúngica, citotóxica totóxica, antipirética, anticonvulsivante, anticancerígena e antiviral (MAHAJAN et al., 1990). Enóis éteres podem ser aplicados como intermediários em reações de síntese de macrolídeos. Costa e colaboradores (2017) sintetizaram o enol éter 1 inédito, a partir do emprego de enaminas alquiladas para a produção de macrolídeos antibióticos. Entretanto, vislumbrando a obtenção deste mesmo enol éter a partir de reações quimicamente verde e em metodologia com menor quantidade de etapas reacionais associou-se o emprego de selênio e irradiações por micro-ondas neste estudo.
Material e métodos
A parte experimental foi executada na Universidade Estadual de Goiás – Campus de Ciências Exatas e Tecnológicas Henrique Santillo, no Laboratório de Síntese, Isolamento e Modificação de Compostos Orgânicos (LabSIMCO). Os reagentes e solventes P. A. foram utilizados sem purificação prévia. A Cromatografia em Camada Delgada (CCD) foi realizada em placa de alumínio com 0,20 mm de sílica gel 60 com indicador de fluorescência UV254 (Macherey- Nagel). Os espectros de infravermelho (IV) foram registrados no espectrômetro Spectrum Frontier (Perkin Elmer). Os espectros de Ressonância Magnética Nuclear (RMN) de Hidrogênio 1H (unidimensional) foram obtidos no Instituto de Química da Universidade Federal de Goiás (IQ/UFG), no qual usado o espectrômetro Bruker Avance III (500 MHz para RMN 1H, 11,7T), com sondas utilizadas (ATB e SW), 5 mm de diâmetro interno, à temperatura ambiente e com pulso de 45º para hidrogênio e carbono. Os deslocamentos químicos (δ) no RMN 1H e de 13C, com dimetilsulfóxido deuterado ((CD3)2SO), foram referenciados com tetrametilsilano (TMS) e com o resíduo de DMSO (δ 2,49), respectivamente. As multiplicidades foram definidas de modo usual, s (simpleto), d (dupleto), dd (duplo dupleto), t (tripleto), q (quadrupleto), m (multipleto). A dicetona 2 (COSTA et al., 2017) foi submetida a reações de α- selenilação (Esquema 1) para a aplicação de nova metodologia sintética para a síntese da dicetona selenilada 3, que será empregada para a síntese do enol éter 1. Procedimento de oxidação do diol para produção da dicetona Costa e colaboradores (2017): A uma solução de 1,58 g (10,0 mmol) do diol 6 em 80 ml de acetato de etila adicionou-se 8,40 g (30,0 mmol) do ácido-2- iodóxibenzóico (IBX), a mistura reacional foi mantida sob agitação magnética constante à temperatura de 80 ºC. A reação foi acompanhada por CCD e após 8 horas filtrou-se a suspensão em celite (60-100 mesh), lavou-se com acetato de etila (3 x 15mL) e evaporou-se o solvente em evaporador rotativo, com a obtenção de um sólido amarelado. Procedimento de α-selenilação via ultrassom: Em um balão de 50 ml adicionou- se 3 ml de DMSO, 0,63 g de I2, 1,71 g de disseleneto e 0,77 g da dicetona 7. E deixou-se a reação por 5 horas via ultrassom, a reação foi acompanhada por CCD com eluição de Hexano/AcOEt 20%, em seguida realizou-se uma extração descontinua com uma solução aquosa de bissulfito de sódio 0,23 mol/L e acetato de etila (3x15 ml), a fase orgânica foi seca com Na2SO4 e o solvente evaporado em evaporador rotativo. Purificou-se o produto em coluna cromatográfica empacotada com sílica gel 230-400 mesh, e eluída com hexano/acetato de etila, e por Cromatografia em camada delgada preparativa CCDP.
Resultado e discussão
A aplicação de selênio em DMSO e I2 para a selenilação da dicetona 2, é uma
metodologia que já vem sendo testada em nosso grupo de pesquisa para a
obtenção da dicetona selenilada 3, e posterior aplicação na síntese do enol
éter 1.
Estas reações de selenilação já foram realizadas por nosso grupo, a partir
de metodologias com o emprego de LDA sob refluxo, I2 e DMSO sob refluxo e
sob irradiação por micro-ondas. Dentre estas três metodologias a melhor foi
a realização sob irradiação por micro-ondas. Entretanto, o rendimento de 80%
evidenciou a presença de matéria-prima em excesso, mesmo variando o tempo
reacional.
Neste trabalho, a aplicação de ultrassom mostrou-se totalmente eficiente em
comparação com as anteriores, por não permanecer matéria-prima no sistema
reacional. O espectro vibracional de absorção na região do infravermelho
(Figura 1) confirmou a estrutura do produto desta síntese na metodologia
proposta, por apresentar picos referentes a CH sp2 aromáticos (v 3085 cm-1),
bandas de absorção referentes aos grupos C=C, C=O e C-Se também foram
confirmadas no espectro de absorção do infravermelho.
Essa metodologia proposta mostrou ser mais eficiente em comparação a reações
de selenilação da dicetona 2, sob refluxo, também desenvolvidas em nosso
grupo de pesquisa. A elucidação estrutural a partir de técnicas de RMN de 1H
e 13C ainda estão sob análises.
Futuramente reações sob irradiação sob micro-ondas serão desenvolvidas para
comparação com os resultados obtidos por ultrassom.
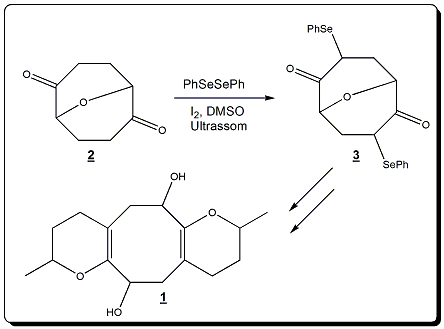
Esquema representação metodologia para a síntese de dicetonas seleniladas.
Conclusões
O desenvolvimento de metodologias sintéticas para a aplicação de selênio em reações com compostos orgânicos vem crescendo constantemente. Diversos são os grupos de pesquisa que aplicam selênio para a obtenção de compostos orgânicos que possam ser fármacos em potencial, ou simples auxiliar como intermediários em reações de síntese. Neste trabalho foi possível aprimorar e estabelecer novas condições reacionais de alfa-selenilação, a partir de estudos de selenilação de dicetonas bicíclicas já estudadas pelo nosso grupo de pesquisa. A aplicação de ultrassom nesta reação foi satisfatória e novas condições reacionais estão em estudo para aprimorar essa metodologia.
Agradecimentos
A UEG pelo apoio e ao auxílio evento; A CAPES pela bolsa concedida; Ao Programa de Concessão de Bolsas de Incentivo ao Pesquisador (ProBIP) 2016.
Referências
BRENNEISEN, P., STEINBRENNER, H., SIES, H. Selenium, oxidative stress, and health aspects. Molecular Aspectsof Medicine, v. 26, p. 256–267, 2005.
CHIARADIA, L. D. Obtenção de Chalconas Sintéticas Com Potencial Atividade Biológica. Dissertação (Mestrado em Química), Universidade Federal de Santa Catarina, Florianópolis, SC, 2006.
COSTA, M. B., MARTINS, M. P., ARAÚJO, H. C., RESCK I. S. Synthesis and Expansion of Bicyclic Enol Ether: A Probable Precursor for the Synthesis of Macrolide (±)-Pyrenophorin, J. Braz. Chem. Soc., V. 00, No. 00, p. 1-5, 2017 (in prelo).
MAHAJAN, J. R.; SILVA, C. R. J. Braz. Chem. Soc. 1990
MILATA, V. naturally occurring enolethers, Acta Chimica Slovaca, Vol.1, No 1,2008, 221 – 237.
NAZARI, M.; MOVASSAGH, B. α-Phenylselenenylation of aldehydes and ketones with diphenyl diselenide mediated by KF/Al2O3.Tetrahedron Lett., v. 50, p. 1453 - 1455, 2009.
NOGUEIRA, C. W., ZENI, G. e ROCHA, J. B. Organoselenium and organotellurium compounds: toxicology and pharmacology. Chem. Rev., v. 104, p. 6255-6285, 2004.
POSSER, T. Efeitos Biológicos E Moleculares De Compostos Orgânicos Sintéticos De Selênio Sobre O Sistema Nervoso Central E Neurotoxicidade do Manganês, Tese (Mestrado), Universidade Federal de Santa Catarina, 2009.
VICTORIA, F. N., Novos Compostos Organosselênio Bioativos: Estudo da Ação Antimicrobiana Frente às Patógenos de Importância em Alimentos, Tese (Mestrado) Universidade Federal de Pelotas, 2010.











