OXIDAÇÃO DA HEMOGLOBINA DE GLOSSOSCOLEX PAULISTUS (HBGP) NA PRESENÇA DE UREIA
ISBN 978-85-85905-23-1
Área
Iniciação Científica
Autores
Pereira da Silva, R. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ) ; Adriano de Oliveira Carvalho, F. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ)
Resumo
A oxidação da HbGp foi investigada em função da concentração de ureia, por espectroscopia no UV-VIS. Os dados mostram que a cinética de oxidação da proteína na presença de ureia na faixa de 1,0 a 5,5 mol/L ocorre em duas etapas: um processo rápido atribuído a oxidação das subunidades da HbGp, monômero e trímero, que inicialmente estão no estado de oxidação Fe2+, para Fe3+ no qual o oxigênio molecular é substituído por um molécula de H2O, cuja constante de velocidade, k1, varia entre (112 e 874) x 10-3s-1, o processo lento é devido a formação de espécies oxidadas como, hemicromo e pentacoordenadas com valores de k2 entre (13 a 63) x 10-3s-1. Ambos os processos são dependentes da concentração de ureia, devido o aumento na concentração de ureia promover a dissociação e desnaturação da HbGp.
Palavras chaves
HBGP; OXIDAÇÃO; UREIA
Introdução
A hemoglobina extracelular gigante de Glossoscolex paulistus é extraída de uma minhoca endêmica do estado de São Paulo. A espécie pertence ao filo Anelídea, à classe Oligochaeta e à família Glossoscolecidae (SANTIAGO et al, 2008). Nos últimos anos tem aumentado o interesse em estudar as hemoglobinas extracelulares gigantes, devido à alta estabilidade oligomérica, resistência à oxidação, alta cooperatividade e afinidade para ligar oxigênio, bem como a presença de atividade peroxidase (ROUSSELOT et al, p. 333-345, 2006). Tais propriedades as tornam bastante singulares e interessantes para estudos com aplicações biotecnológicas. A macroproteína em estudo apresenta uma massa molecular de 3,6 MDa e uma disposição organizada envolvendo 144 cadeias polipeptídicas com grupo heme e 36 cadeias polipeptídicas sem grupos heme, denominadas de cadeias Linker . Sua estrutura oligomérica é composta de dois discos hexagonais, que formam uma espécie de bicamada hexagonal. Cada camada é constituída por seis unidades (protômeros) de massa molecular 1/12 da molécula íntegra (ROYER, et al, p. 297-304, 2001). Grandes avanços na caracterização da HbGp, e sobre o efeito de agentes desnaturantes, variação de temperatura e pH, adição de agentes químicos surfactantes, guanidina e ureia nos processos de dissociação, desnaturação e agregação da HbGp foram obtidos. No entanto, pouco é conhecido sobre mudanças estruturais e as interações a nível molecular destes agentes com a estrutura desta proteína. Assim, o presente trabalho tem como objetivo avaliar a cinética do processo de desnaturação desta proteína em função da concentração de ureia em temperatura ambiente, a fim de fornecer informações importantes sobre o mecanismo de desenovelamento desta macromolécula.
Material e métodos
A HbGp foi extraída e purificada, como reportado na literatura (SANTIAGO et al, 2010). Posteriormente, a amostra de proteína na concentração de 0,1 mg/mL, na forma oxi-HbGp, foi preparada a partir de estoque concentrado de 10 mg/mL, em tampão acetato-fosfato 30mM, pH 7,0. Estoque de ureia 10,0 M foi preparado no mesmo tampão. A adição de ureia altera o pH da solução, sendo o mesmo corrigido para 7,0. Inicialmente foram realizadas as diluições para preparar as concentrações de ureia numa faixa de 1,0 a 5,5 M, por meio da adição de volumes adequados de tampão acetato-fosfato 30 mM e do estoque de ureia, e em seguida foi feita a homogeneização das amostras, e posteriormente adicionado alíquotas de proteína. Os experimentos foram realizados num espectrofotômetro UV-VIS da Biospectro, monitorando a variação da absorbância da amostra no comprimento de onda 414nm em função do tempo. Realizou-se todos estes experimentos em triplicatas. As constantes de velocidades para cada concentração de desnaturante foram obtidas a partir de ajustes dos dados experimentais no Origin, utilizando a combinação de cinéticas de primeira ordem com diferentes constantes de velocidades, que caracterizam os vários processos resultantes da interação da proteína com os desnaturantes. A equação usada nas análises dos dados é mostrada a seguir: A = ∆A1exp(-k1*t) + ∆A2exp(-k2*t) + A0 (Equação 1) Onde k1 e k2 são as constantes de velocidade de primeira ordem para os processos de oxidação rápido e lento, respectivamente. ∆A1 e ∆A2 são as variações de absorbância e A0 é a absorbância no infinito. Os ajustes através da equação 1 apresentaram valores de R2 ≥ 0,994, e indicam que a oxidação da HbGp na presença de ureia é caracterizada por um processo bi exponencial.
Resultado e discussão
A Figura 1A mostra os espectros de absorção da HbGp na presença de 1,0 mol/L
de ureia, em função do tempo, e nenhuma mudança espectral é observada,
indicando que a proteína permanece na forma reduzida. O aumento na
concentração de ureia para 3,0 e 5,0 mol/L promove um redução drástica na
intensidade da banda de Soret, que é acompanhado por um deslocamento para o
azul no máximo de absorção das bandas de Soret e Q (Figuras 1B e 1C), que
são atribuidos a formação das espécies oxidadas, aquometa-HbGp e hemicromo.
A Figura 1D mostra a variação da absorbância (abs) da HbGp em função do
tempo em diferentes concentrações de ureia, a 25ºC. O aumento da
concentração de ureia induz um decréscimo nos valores de absorbância em
função do tempo, devido a ureia favorecer a oxidação da proteína. O
nucleófilo que atua no processo de auto-oxidação é a molécula de água, que
seria então deslocada pelo imidazol da histidina distal para a formação do
hemicromo, que é uma espécie final comum à dissociação e desnaturação das
hemoproteínas.
As constantes de velocidades em diferentes concentrações de ureia são
reportadas na Tabela 1. Até 2,0 mol/L de ureia a taxa de variação de abs é
tão lenta, que não foi possível obter os valores de k do processo. Na
presença de 3,0 mol/L do desnaturante as constantes de velocidades do
processo rápido e lento, k1 e k2, são (112 ± 3) x 10-3 s-1 e (13 ± 0,5) x
10-3 s-1, respectivamente. O aumento da concentração de ureia favorece ambos
os processos que são caracterizados por k1 e k2 com valores de (874 ± 28) x
10-3 s-1 e (63 ± 5) x 10-3 s-1. Essas constantes são atribuídas aos
processos de oxidação das subunidades da HbGp, monômeros d e trímeros abc,
inicialmente no estado enovelado, e dissociada/desnaturada que predominantes
em altas concentrações de ureia.
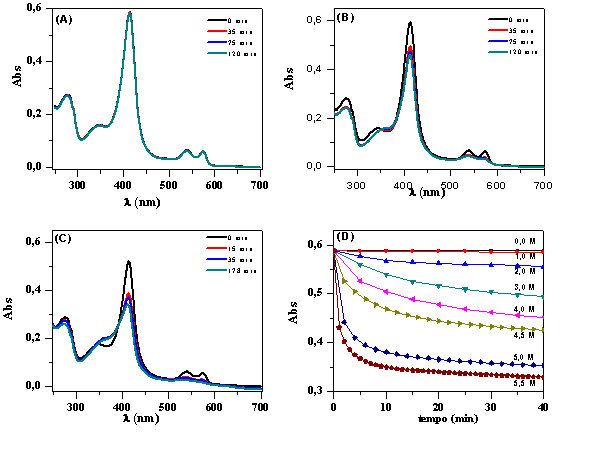
Espectros da HbGp 0,1 mg/mL, em tampão acetato- fosfato 30 mM, pH 7,0, na presença de 1,0 M (A), 3,0 M (B), 5,0 M (C) de ureia, (D) Absorção em 415 nm.
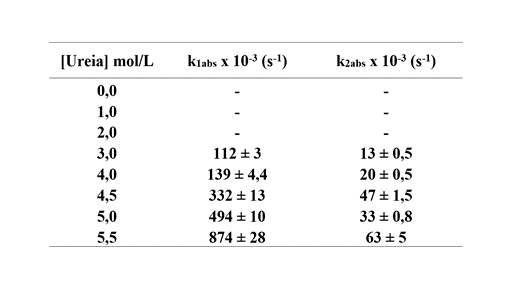
Constantes cinéticas de auto-oxidação da hemoglobina de Glossoscolex paulistus no pH 7,0 em função da concentração de ureia.
Conclusões
O presente estudo mostra que o decaimento na intensidade de absorção do heme está relacionado à perda de estrutura da proteína, processo este provocado pela ureia. O processo de auto-oxidação da HbGp na presença de ureia nas concentrações investigadas ocorre em duas etapas: um processo rápido atribuído à oxidação do monômero d e trímero abc dissociado/desnaturado e um lento devido à oxidação destas espécies quando estão compactas na estrutura oligomérica da HbGp.
Agradecimentos
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo incentivo à pesquisa. Ao laboratório de Sedimentologia do IGE-UNIFESSPA.
Referências
1. SANTIAGO, P.S.; MOURA, F.; MOREIRA, L.M.; DOMINGUES, M.M.; SANTOS, N.C.; TABAK, M. Biophys. J., 94:2228-2240, 2008.
2. ROUSSELOT, M.; DEL´PY, E.; LA ROCHELLE, C.D.; LAGENTE, V.; PIROW, R.; REES, J.; HAGEGE, A.; LE GUEN, D.; HOURDEZ, S.; ZAL, F. Biotechnology J., 1:333-345, 2006.
3. ROYER, W.E.; KNAPP, J.E.; STRAND, K.; HEASLET, H.A. Trends Biochem. Sci., 26:297-304, 2001.
4. SANTIAGO, P.S.; CARVALHO, F.A.O.; DOMINGUES, M.M.; CARVALHO, J.W.P.; SANTOS, N.C.; TABAK, M. Isoelectric Point Determination for Glossoscolex paulistus Extracellular Hemoglobin: Oligomeric Stability in Acidic pH and Relevance to Protein-Surfactant Interactions. Langmuir, 2010.
5. CARVALHO, F.A.O.; SANTIAGO, P.S.; BORGES, J.C.; TABAK, M. Anal. Biochem., 385:257-263, 2008.











