SÍNTESE DO COMPLEXO INORGÂNICO [Fe(AT)](SO4), ONDE AT=ÁCIDO TARTÁRICO
ISBN 978-85-85905-23-1
Área
Química Inorgânica
Autores
Dias, J.W.G. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Nascimento, M.C. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Oliveira Filho, M.A.C. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Silva, W.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE)
Resumo
Os complexos de coordenação são definidos como compostos constituídos por átomos ou íons metálicos ligados a átomos ou grupos de átomos chamados ligantes.O íon ferro tem uma grande importância biológica, está no transporte de elétrons em plantas e animais, no transporte de oxigênio no sangue de mamíferos e no armazenamento de oxigênio. O Ácido tartárico é um ácido específico muito pouco vegetal, encontrando-se quase exclusivamente na videira onde tem grande importância e é utilizado como antioxidante. Buscou-se complexar o íon ferro ao ligante ácido tartárico, na forma de tartarato. As mudanças de coloração no decorrer da síntese demonstram que ocorreu reação entre eles. Com isso, objetiva-se ainda melhorar as características biológicas do ácido tartárico.
Palavras chaves
Síntese; Ácido Tartárico; Complexos de Coordenação
Introdução
Os complexos de coordenação são definidos como compostos constituídos por átomos ou íons metálicos ligados a átomos ou grupos de átomos chamados de ligantes. Os íons metálicos são os ácidos de Lewis e os ligantes são as bases de Lewis. Os complexos possuem características interessantes de magnetismo, atividade biológica e podendo ser aplicados na medicina e como catalisadores (RAMOS, 2011). Para as plantas e animais, o íon ferro é o elemento mais importante dentre os metais de transição. Sua importância biológica está no transporte de elétrons em plantas e animais, no transporte de oxigênio no sangue de mamíferos e no armazenamento de oxigênio,ele forma diversos complexos de estruturas pouco comuns, como o ferroceno (J.D.LEE, 1999). O ácido tartárico, é um ácido aldáricodiprótico cristalino branco. Ocorre naturalmente em muitas plantas, particularmente uvas, bananas e tamarindos, e é um dos principais ácidos encontrados no vinho. Apresenta grandes vantagens na área alimentícia, farmacêutica e industrial, até mesmo para produtos alimentícios para finalidade veterinária e é utilizado como antioxidante. (RIZZON; MIELE, 2001). Buscou-se complexar o íon ferro ao ligante ácido tartárico, na forma de tartarato, com o objetivo de buscar um novo complexo inorgânico capaz de funcionar como potente antioxidante.
Material e métodos
Para a elaboração dessa síntese foram utilizados o sal de sulfato de ferro I) heptahidratado, FeSO4.7H20 e o ligante em forma de sal de Tartarato de Sódio e Potássio, KNaC4H4O6·4H2O, o solvente utilizado foi água destilada. Na preparação do complexo [Fe(AT)2] (SO4), onde AT=Ácido Tartárico, inicialmente foi dissolvido sulfato de ferro (II) (FeSO4, 0,06g) em 20 mL de água e adicionado à solução de tartarato de sódio e potássio dissolvido em água destilada e foi deixado sob agitação por 20 minutos. Após o tempo decorrido, adicionou-se 3 gotas de trietilamina e foi mantido sob agitação por 2 horas, em temperatura ambiente. Depois do período de agitação, foi adicionado álcool etílico gelado (300 ml). Foi mantido sob refrigeração por 48 horas, filtrado em funil de placa porosa e estocado em dessecador sob vácuo.
Resultado e discussão
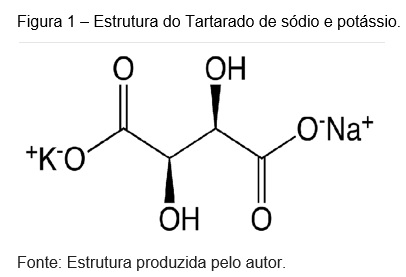
A solução de sulfato de ferro (II) que é translúcida logo após a adição do
ligante, tartarato de sódio e potássio, Figura 1, apresentou uma mudança de
coloração, amarelada. Decorrido cerca de dez minutos a cor da solução mudou
novamente para um verde musgo. Depois dos 20 minutos iniciais de agitação,
adicionou-se trietilamina e logo observou-se uma nova mudança brusca e rápida de
coloração para o âmbar. Ao finalizar a síntese, não se observou precipitado,
sugerindo que o complexo é solúvel em água. Então colocou-se o composto em
álcool etílico gelado para induzir a precipitação e após 48 horas sob
refrigeração, observou-se um precipitado laranja.
Conclusões
De acordo com os resultados obtidos na síntese do composto [Fe(AT)2] (SO4) conclui-se que ocorreu a coordenação do ligante ao íon metálico. A formação do complexo [Fe(AT)2](SO4) apresenta- se propícia para estudos biológicos posteriores, uma vez que, pretende aumentar ainda mais as propriedades do ácido tartárico após coordenação, unindo as características químicas e biológicas da molécula de ácido tartárico com propriedades inorgânicas com o centro do íon ferro. A perspectiva deste trabalho será a caracterização por outras técnicas de análise.
Agradecimentos
A Universidade Estadual do Ceará (UECE), a equipe do Laboratório de Química Inorgânica (LQUIN), e a Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnoló
Referências
J.D.LEE. Química Inorgânica não tão concisa. São Paulo: Edgard Blucher, 1999.
RAMOS, P. H.; Complexos Metálicos (Ferro, Níquel e Cobalto) em Sistemas de Oxidação do Tipo Fenton: Reações e Mecanismos. 2011. 115 f. Tese (Doutorado) - Curso de Agroquímica, Universidade Federal de Lavras, Lavras, 2011.
RIZZON, Luiz Antenor; MIELE, Alberto. Concentração de Ácido tartárico dos vinhos da serra gaúcha. Ciência Rural, Santa Maria, v. 31, n. 5, p.893-895, jan. 2001.











