Modelagem Molecular de Novos Inibidores da PKs13 do Mycobacterium tuberculosis
ISBN 978-85-85905-23-1
Área
Físico-Química
Autores
Neves Cruz, J. (UNIVERSIDADE FEDERAL DO PARÁ) ; Henrique de Souza Mendes, M. (UNIVERSIDADE FEDERAL DO PARÁ) ; Ferreira de Moraes Junior, E. (UNIVERSIDADE FEDERAL DO PARÁ) ; de Sousa Miranda, I. (UNIVERSIDADE FEDERAL DO PARÁ) ; Mayara da Silva Soares, A. (UNIVERSIDADE FEDERAL DO PARÁ) ; Mendes de Albuquerque, S. (UNIVERSIDADE FEDERAL DO PARÁ) ; Gemaque de Medeiros, I. (UNIVERSIDADE FEDERAL DO PARÁ) ; Alberto Nascimento de Alencar, N. (UNIVERSIDADE FEDERAL DO PARÁ) ; Henrique Lima e Lima, A. (UNIVERSIDADE FEDERAL DO PARÁ) ; Maia de Jesus Chaves Neto, A. (UNIVERSIDADE FEDERAL DO PARÁ)
Resumo
Neste trabalho o modo de ligação de novos inibidores da Policetídeo Sintase 13 foram estudados por meio de simulações de dinâmica molecular e cálculos de energia livre. Os inibidores foram submetidos a simulações de dinâmica molecular de 100 nanosegundos e de acordo com os resultados de desvio quadrático médio todas as simulações convergiram a partir de aproximadamente 30 nanosegundos. O valor de energia livre de ligação para a molécula lead Tam16 foi de -52.21 kcal/mol e para o análogo Tam3 foi de –48.93 kcal/mol. A análise de decomposição de energia livre sugere que os resíduos que mais interagem com os inibidores são: Ser1636, Tyr1637, Asn1640, Ala1667, Phe1670 e Tyr1674, desses destaca-se a maior contribuição energética para o Phe1670.
Palavras chaves
Pks13; inibidores; dinâmica molecular
Introdução
A Tuberculose (TB) é uma doença infectocontagiosa transmitida pelo ar que mata no mundo 1.5 milhões de pessoas por ano. A TB afeta principalmente os pulmões, mas pode ocasionar danos a outros órgãos como ossos, rins e meninges (FLOYD et al., 2018). Para novos casos de TB o tempo de tratamento é de em média seis meses e o sucesso é acima de 80%. No entanto, a tuberculose multirresistente (MDR-TB) e a tuberculose extensivamente resistente (XDR-TB) representam uma ameaça à saúde global. Para o tratamento da TB-MDR e XDR-TB é necessário a utilização combinada de medicamentos (PRASAD, 2012). A isoniazida (INH) é utilizada contra todos os tipos de tuberculose, podendo ser usada em conjunto com outros fármacos. Os seus metabolitos irão se ligar ao Nicotinamida Adenina Dinucleótido (NAD), formando um complexo que irá inibir a enzima enoil-ACP redutase (InhA), que é fundamental para a via de síntese de ácidos micólicos (UNISSA et al., 2016). Devido a grande importância do ácido micólico para a virulência e patologia da TB, o conhecimento da sua biossíntese e das enzimas envolvidas é extremamente importante para que novos alvos contra a doença possam ser estudados (SMITH, 2003). Para que o ácido micólico seja sintetizado é necessário a utilização da enzima Policetídeo Sintase 13 (Pks 13). Essa enzima atua na fase final de síntese do ácido graxo auxiliando na condensação das cadeias (GAVALDA et al., 2014). Nesse trabalho, descrevemos os resultados da simulação por dinâmica molecular (MD) dos inibidores Tam16 e Tam3 da Pks 13. Logo após as simulações, usamos o método molecular mechanics/Generalized-Born surface area (MM/GBSA) para calcular a energia livre de ligação e para decompor a energia livre.
Material e métodos
Protocolo de Dinâmica Molecular As estruturas cristalinas da Pks 13 ligada com os inibidores Tam16 e Tam3 podem ser localizadas no Protein Data Bank com o ID: 5V3Y e 5V42, respectivamente (AGGARWAL et al., 2017). Todos os átomos dos inibidores tiveram suas cargas atômicas calculadas usando o protocolo de Restrained Electrostatic Potential (RESP) (CORNELL et al., 1993) com o software Gaussian 16 (FRISCH et al., 2016) usando HF/6-31G*. Os campos de força General Amber Force Field (GAFF) (WANG et al., 2004) e ff14SB (MAIER et al., 2015) foram utilizados para as simulações em solvente explicito com moléculas de água descritas pelo modelo TIP3P (JORGENSEN et al., 1983). As minimizações de energia foram realizadas no modulo sander do Amber 16 (CASE et al., 2005) em quatro etapas. Em cada etapa foram realizados 5000 ciclos utilizando o metodo steepest descent e o algoritmo conjugate gradiente. Após a minimização, os sistemas foram gradualmente aquecidos de 0 a 300k em 6 etapas, durante um tempo total de 600 ps. Essas etapas foram realizadas utilizando o termostato de Langevin (IZAGUIRRE et al., 2001) com frequência de colisão de 3.0 ps−1. Em seguida para o equilíbrio do sistema foi realizado uma simulação de 2 nanosegundos (ns) a uma temperatura de 300k. O cálculo das interações eletrostáticas foi realizado utilizando o metodo Particle Mesh Ewald (DARDEN; YORK; PEDERSEN, 1993) e o algoritmo SHAKE (RYCKAERT et al., 1977) foi usado para restringir os comprimentos de ligação envolvendo os átomos de hidrogênio. Após essas etapas foram realizadas simulações de dinâmica molecular de produção até 100 ns. Cálculos de Energia Livre de Ligação As energias livres de ligação foram calculadas utilizando o método MM/GBSA (CHEN et al., 2016) usando os últimos 5 ns da trajetória de DM.
Resultado e discussão
De acordo com nossos resultados de RMSD (do inglês - Root Mean Square Deviation) os dois complexos convergiram durante a simulação de dinâmica molecular. A estabilidade
dos ligantes ocorreu principalmente a partir dos 30 ns de simulação como pode ser observado na Figura 1.
Os valores de energia livre obtidos para os sistemas foram os seguintes: Pks13-Tam16: -52.21 kcal/mol e Pks13-Tam3: -48.93 kcal/mol. Para os dois sistemas as
contribuições de van der Waals, eletrostáticas e energia de solvatação não polar foram favoráveis para a interação proteína-inibidor. Para todos os complexos a maior
contribuição para a ligação dos inibidores ao sítio ativo da proteína ocorreu devido as contribuições de van der Waals. AS contribuições não polares entre as três
contribuições favoráveis ao sistema, foi o termo que menos contribuiu para a energia livre total.
A Figura 2 demonstra o espectro da decomposição de energia livre por resíduo.
Para todos os resíduos exibidos a principal energia responsável pela ligação ao sitio ativo da Pks13 foram as contribuições de van der Waals (ΔEvdW). A soma das
interações eletrostáticas (ele+GB) e a energia de solvatação não polar contribuíram pouco para interação com a proteína, em alguns complexos essas interações foram
desfavoráveis. O resíduo de Phe1670 em todos os sistemas foi o que mais interagiu com o inibidor, com aproximadamente -4 kcal/mol de energia de van der Waals (ΔEvdW).
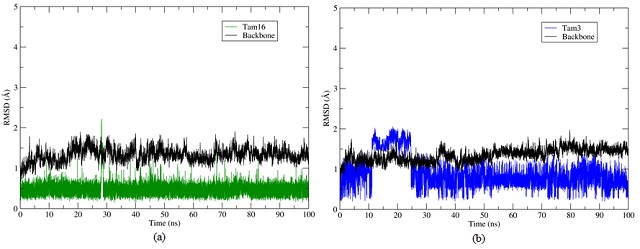
RMSD dos complexos Pks13-ligantes.
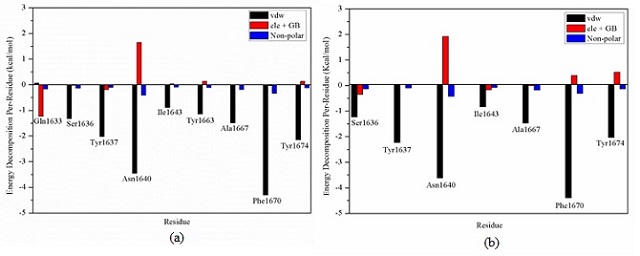
Componentes energéticos das interações realizadas pelos resíduos do sítio ativo da proteína com os inibidores. (a) Pks13-Tam16 e (b) Pks13-Tam3.
Conclusões
Nossos resultados de energia livre demonstram que a formação dos complexos é favorável. Com as análises de decomposição de energia livre por resíduo é possível observar que a Ser1636, Tyr1637, Asn1640, Ala1667, Phe1670 e Tyr1674, de maneira geral, interagem com os dois ligantes. O resíduo de Asn1640 realizou predominantemente interações de van der Waals, sendo assim, um resíduo importante para a interação droga-receptor. O Phe1670 também demonstrou importante contribuição para a interação com as moléculas em estudo, pois em todos os complexos foi o resíduo que mais interagiu com o ligante.
Agradecimentos
Neves Cruz, J. e Maia de Jesus Chaves Neto, A. agradecem o apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e da Universidade Federal do
Referências
AND, R. T. et al. MolDock: A New Technique for High-Accuracy Molecular Docking. Journal of Medicinal Chemistry, v. 49, n. 11, p. 3315–3321, 2006.
CASE, D. A. et al. The Amber biomolecular simulation programs. Journal of Computational Chemistry, v. 26, n. 16, p. 1668–1688, dez. 2005.
CORNELL, W. D. et al. Application of RESP charges to calculate conformational energies, hydrogen bond energies, and free energies of solvation. Journal of the American Chemical Society, v. 115, n. 21, p. 9620–9631, out. 1993.
DEVORE, N. M.; SCOTT, E. E. Nicotine and 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone binding and access channel in human cytochrome P450 2A6 and 2A13 enzymes. The Journal of biological chemistry, v. 287, n. 32, p. 26576–85, 3 ago. 2012.
DOLINSKY, T. J. et al. PDB2PQR: an automated pipeline for the setup of Poisson-Boltzmann electrostatics calculations. Nucleic Acids Research, v. 32, n. Web Server, p. W665–W667, 1 jul. 2004.
FARSALINOS, K. E. et al. Tobacco-Specific Nitrosamines in Electronic Cigarettes: Comparison between Liquid and Aerosol Levels. International journal of environmental research and public health, v. 12, n. 8, p. 9046–53, 31 jul. 2015.
FURRUKH, M. Tobacco Smoking and Lung Cancer: Perception-changing facts. Sultan Qaboos University medical journal, v. 13, n. 3, p. 345–58, ago. 2013.
GENHEDEN, S.; RYDE, U. The MM/PBSA and MM/GBSA methods to estimate ligand-binding affinities. Expert Opinion on Drug Discovery, v. 10, n. 5, p. 449–461, 4 maio 2015.
JORGENSEN, W. L. et al. Comparison of simple potential functions for simulating liquid water. The Journal of Chemical Physics, v. 79, n. 2, p. 926–935, 15 jul. 1983.
MAIER, J. A. et al. ff14SB: Improving the Accuracy of Protein Side Chain and Backbone Parameters from ff99SB. Journal of Chemical Theory and Computation, v. 11, n. 8, p. 3696–3713, 11 ago. 2015.
PINHEIRO, M. DE A. et al. Prevalence and Associated Factors of AlcoholmConsumption and Smoking among Medical Students in Northeastern Brazil. Revista Brasileira de Educação Médica, v. 41, n. 2, p. 231–239, jun. 2017.
SAHA, S. P. et al. Cigarette smoke and adverse health effects: An overview of research trends and future needs. The International journal of angiology : official publication of the International College of Angiology, Inc, v. 16, n. 3, p. 77–83, 2007.
SHIMADA, T. Inhibition of Carcinogen-Activating Cytochrome P450 Enzymes by Xenobiotic Chemicals in Relation to Antimutagenicity and Anticarcinogenicity. Toxicological research, v. 33, n. 2, p. 79–96, abr. 2017.
WANG, J. et al. Development and testing of a general amber force field. Journal of Computational Chemistry, v. 25, n. 9, p. 1157–1174, 15 jul. 2004.











