Estudo da eletro-oxidação do glicerol sobre nanopartículas de PtRhSn
ISBN 978-85-85905-23-1
Área
Físico-Química
Autores
Santos, W. (UNIVERSIDADE FEDERAL DO MARANHÃO) ; Lima, R. (UNIVERSIDADE FEDERAL DO MARANHÃO)
Resumo
A eletro-oxidação do glicerol foi estudada sobre nanopartículas trimetálicas de PtRhSn/C em meio ácido. As nanopartículas foram sintetizadas através do método do poliol, utilizando o etileno-glicol como redutor, com diferentes composições. As medidas eletroquímicas foram feitas utilizando as técnicas voltamétricas e cronoameperométricas. Observou-se que no catalisador com maior presença de Sn, Pt80Rh5Sn15/C, houve um deslocamento no potencial de início mais significativo se comparado as outras nanopatículas sintetizadas, que indicar que o Sn favorece a oxidação do glicerol em potenciais mais baixos devido a seu maior caráter oxidativo. O eletrocatalisador Pt80Rh5Sn15 possuiu maior atividade eletrocatalítica, além de obter um boa estabilidade de corrente em relação aos demais catalisadores.
Palavras chaves
eletro-oxidação; glicerol; nanopartículas
Introdução
Atualmente os álcoois de cadeia pequena como metanol, etanol e etileno glicol vem sendo estudados para serem possíveis substitutos do hidrogênio em sistemas conversores de energia denominados de células a combustível (GONZALEZ, 2000). Afim de se obter energia limpa com uma eficiência superior aos motores a combustão. Nestes dispositivos hidrogênio gasoso e os álcoois de cadeia pequena vem sendo usados como possíveis combustíveis. Os álcoois de cadeia pequena possuem uma densidade energética superior ao hidrogênio molecular (LAMY, BELGSIR e LEGER, 2001). Da mesma forma que em uma célula a hidrogênio, em uma célula a combustível direta a álcool (DAFC), o combustível é inserido no ânodo da célula, onde se encontra o catalisador metálico que tem o papel de oxidar o álcool. No cátodo da célula, é injetado oxigênio gasoso (VIELSTICH, GASTEIGER e YOKOKAWA, 2009). Um álcool que vem chamando a atenção de diferentes grupos de pesquisa é o Glicerol (Fernadez, et al., 2012; Garcia, et al., 2017; Lei, et al., 2016; Delpeuch, et al., 2015). A eletrooxidação de glicerol vem sendo estudada, fundamentalmente sobre eletrodos à base de platina em meio ácido. Para aumentar a eficiência da Pt em romper a ligação C–C, ela vem sendo utilizada em conjunto com ródio (Rh) [9-10]. Essa ruptura tem se configurado como um dos principais problemas encontrados no estudo de álcoois contendo mais de dois carbonos. A inclusão do estanho (Sn) na composição do catalisador visa facilitar a oxidação de resíduos provenientes da oxidação do álcool sobre os sítios de platina facilitando assim o progresso da reação de oxidação do álcool (LIMA e GONZALEZ, 2008).
Material e métodos
Todos as vidrarias foram lavadas utilizando solução alcalina de KMnO7 e solução de H2O2 e H2SO4. Após a lavagem com essas soluções as vidrarias foram colocadas em um béquer com água e em seguida foram aquecidas por 10 min. Os reagentes utilizados foram H2PtCl6.6H2O da Sigma Aldrich, Cl3Rh · xH2O Sigma Aldrich, SnCl2.2H2O Merck, Carbon Vulcan XC-72, H2SO4 (96%) Merck. O tratamento de funcionalização do carbono foi feito utilizando 5 molL-1 de H3NO4 colocando em um sistema de refluxo por 4 horas a uma temperatura de 80°C. Realizou-se filtração para obter um carbono funcionalizado. A síntese por redução química teve como principal agente o etileno-glicol agindo como redutor. A síntese das nanopartículas foram feitas utilizando um sistema de refluxo, um balão volumétrico de 250mL foi utilizado, nele adicionava os precursores do metal e o carbono juntamente com etileno-glicol (75% v/v). Em seguida o balão foi deixado no banho ultrassônico por 20 minutos. Após esse processo a mistura é colocada no sistema de refluxo por 3 horas a uma temperatura de 80-90°C. Realizou-se processo de filtragem para obter os catalisadores. As medidas eletroquímica foram feitas utilizando o potenciostato PAR-263. A faixa de potencial utilizada na voltametria cíclica foi de 0,05 a 0,9 V nas medidas do branco, em que não envolviam o glicerol, e 0,05 a 1,1 V nas medidas com glicerol. A velocidade de varredura utilizada foi de 50 mVs-1. A cronoamperometria foi realizada com potencial fixo de 500mV durante 15 minutos.
Resultado e discussão
Na Figura 1 é apresentado o voltamograma da Pt/C em meio ácido. Observa-se, na
faixa de 0,05 a 0,4 V, picos provenientes da adsorção e desorção do
hidrogênio. Em 0,4 a 0,45 V não há presença de corrente faradacas, mas sim de
correntes capacitivas, indicando a não ocorrência do processo de transferência
de carga. A formação de óxido inicia-se próximo a 0,8 V. Nota-se que houve um
grande aumento na área ativa do catalisador Pt80Rh5Sn15, por outro lado, o
segundo catalisador trimetálico apresenta uma redução em sua área se comparado
com o eletrocatalisador de Pt/C.
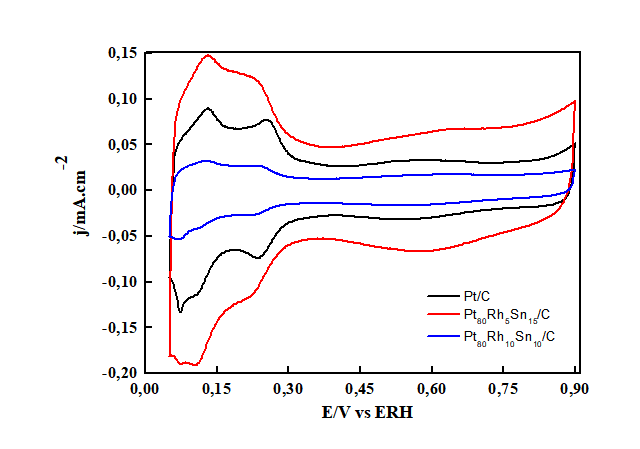
Voltamogramas Cíclicos para os três catalisadores de Pt em 0,5 M de H2SO4. Intervalo: 0,05 V - 0,90 V. v = 0,010 V s-1. T = 25 °C.
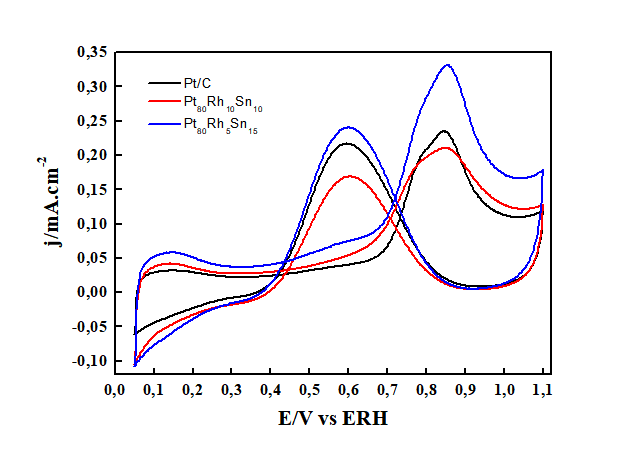
Voltamogramas Cíclicos para os três catalisadores de Pt em na presença de glicerol. Intervalo: 0,05 V - 1,1 V. v = 0,010 V s-1. T = 25 °C.
Conclusões
Os resultados voltamétricos mostraram que o catalisador com melhor desempenho foi o Pt80Rh5Sn15. Dados obtidos por meio de curvas corrente vs tempo (cronoamperometria) apresentaram para este mesmo catalisador uma maior densidade de corrente bem como uma melhor estabilidade que os demais catalisadores. A adição de Sn favorece mais a formação de óxidos o que contribui para a oxidação do CO e de outros resíduos presentes na superfície do catalisador.
Agradecimentos
A FAPEMA pela bolsa concedida (PIBIC-UFMA) e a CAPES (PROCAD nº 3007/2014).
Referências
DELPEUCH, A. et al. Influence of H-and OH-adsorbates on the ethanol oxidation reaction--a DEMS study. Physical Chemistry Chemical Physics, v. 17, n. 16, p. 10881--10893, 2015.
FERNADEZ, P. S. et al. The electro-oxidation of isotopically labeled glycerol on platinum: New information on C--C bond cleavage and CO2 production. Electrochemistry Communications, v. 15, n. 1, p. 14-17, 2012.
GARCIA, A. C. et al. Glycerol electro-oxidation on bismuth-modified platinum single crystals. Journal of Catalysis, v. 346, p. 117--124, 2017.
GONZALEZ, E. R. Eletrocatálise e poluição ambiental. Química Nova, v. 23, n. 2, p. 262 - 266, 2000.
LAMY, C.; BELGSIR, E. M.; LEGER, J. M. Electrocatalytic oxidation of aliphatic alcohols: application to the direct alcohol fuel cell (DAFC). Journal of Applied Electrochemistry, v. 31, n. 7, p. 799 - 809, 2001.
LEI, J. et al. Insights into activated carbon-supported platinum catalysts for base-free oxidation of glycerol. Industrial \& Engineering Chemistry Research, v. 55, n. 2, p. 420--427, 2016.
LIMA, F. H. B.; GONZALEZ, R. Electrocatalysis of ethanol oxidation on Pt monolayers deposited on carbon-supported Ru and Rh nanoparticles. Applied Catalysis B: Environmental, v. 79, n. 4, p. 341--346, 2008.
VIELSTICH, W.; GASTEIGER, H. A.; YOKOKAWA, H. Handbook of Fuel Cells: Fundamentals Technology and Applications: Advances in Electrocatalysis, Materials, Diagnostics and Durability. [S.l.]: John Wiley & Sons, v. 5, 2009.











