Comportamento Voltamétrico da Chalcona [2E-1-(2’-Hidroxi-3’,4’,6’-trimetoxifenil)-3-(fenil)-prop-2-en-1-ona] Derivada da 2-Hidróxi-3,4,6-trimetoxiacetofenona Isolada de Croton anisodontus
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Julião, M.S.S.J. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Santos, H.S. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Silva, P.T. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Bandeira, P.N. (UNIVERSIDADE ESTADUAL VALE DO ACARAÚ) ; Xavier, J.C. (UNIVERSIDADE REGIONAL DO CARIRI) ; Teixeira, A.M.R. (UNIVERSIDADE REGIONAL DO CARIRI)
Resumo
As chalconas são importantes intermediários na síntese de compostos biologicamente ativos como os flavonoides e seus derivados. Neste trabalho, foi realizado o estudo do comportamento eletroquímico da chalcona 2E-1-(2’- Hidróxi-3’,4’,6’-trimetóxifenil)-3-(fenil)-prop-2-en-1-ona (HYTPHENYL) sintetizada a partir da 2-Hidróxi-3,4,6-trimetoxiacetofenona isolada da casca do caule de Croton anisodontus. O mecanismo de oxirredução do HYTPHENYL em meio aquoso envolve 2 elétrons, num processo irreversível compreendido de duas transferências sucessivas de 1 elétron no mesmo potencial. A oxidação do HYTPHENYL envolve a formação de um radical fenoxil resultante da retirada de 1 elétron do grupo 2’-hidroxila e abstração de 1 íon H+ e na sequência, o radical fenoxil muito provavelmente forma um dímero.
Palavras chaves
Estudo eletroquímico; HYTPHENYL; Produtos naturais
Introdução
As chalconas e seus derivados têm recebido grande atenção da comunidade científica por causa de suas estruturas simples e por apresentar uma grande diversidade de atividades farmacológicas (CHIARADIA et al, 2008; BERAR, 2012; ABU et al, 2013; SINGH et al, 2014). Recentemente, foi reportado que a 2-hidróxi-3,4,6-trimetóxiacetofenona (C11O5H14), um produto natural isolado da casca do caule de Croton anisodontus Müll. Arg. apresenta efeito modulador da atividade dos antibióticos amicacina, gentamicina e neomicina frente a diferentes linhagens multirresistentes (OLIVEIRA et al, 2014). Este estudo mostra que a 2-hidróxi-3,4,6-trimetóxiacetofenona quando associada ao antibiótico amicacina apresenta sinergismo contra Pseudomonas aeruginosa 03 e Staphylococcus aureus 358. Por outro lado, nenhum efeito sobre o crescimento bacteriano foi detectado contra cepas de Escherichia coli 27 e Staphylococcus aureus 358 quando foi associada ao antibiótico gentamicina. Entretanto, além da importância de se analisar a atividade antimicrobiana e a resistência aos antibióticos necessita-se também correlacionar os mecanismos de ação desses novos compostos bioativos aos seus processos de oxirredução ocorrendo intracelularmente. Portanto, o alvo principal deste trabalho foi o estudo do comportamento eletroquímico em meio aquoso e in vitro, de uma nova chalcona, a 2E-1-(2’-hidróxi- 3’,4’,6’-trimetóxifenil)-3-(fenil)-prop-2-en-1-ona (C18O5H18, denominada HYTPHENYL), sintetizada por meio da condensação de Claisen-Schmidt em meio alcalino (WANG, 2009) a partir de uma acetofenona isolada das cascas do caule de C. anisodontus Müll. Arg., a 2-hidróxi-3,4,6-trimetóxiacetofenona (C11O5H14, denominada HTMCX).
Material e métodos
Síntese da Chalcona HYTPHENYL: A chalcona utilizada neste foi sintetizada segundo o esquema apresentado na Figura 1. Os materiais de partida foram o produto natural 2-hidróxi-3,4,6-trimetóxiacetofenona (HTMCX) (1) e benzaldeído (2) adquirido da Sigma-Aldrich. A chalcona derivada 2E-1- (2’-hidróxi-3’,4’,6’-trimetóxifenil)-3-(fenil)-prop-2-en-1-ona (HYTPHENYL) (3) foi sintetizada a partir da agitação da solução contendo o composto HTMCX (1) (0,2000 g; 0,62 mmol), etanol (10,0 mL), NaOH (0,2500 g; 6,5 mmol) e benzaldeído (0,1093 g; 1,03 mmol) (2) à temperatura ambiente por 2 horas. Os dados de infravermelho, RMN e EM confirmaram a síntese da chalcona HYTPHENYL (3). Medidas eletroquímicas: O estudo voltamétrico da chalcona HYTPHENYL foi realizado numa célula eletroquímica convencional para três eletrodos acoplada a um potenciostato/galvanostato μAutolab III (Metrohm Autolab) interfaceado com o programa NOVA 2.1.3. Carbono vítreo (ECV), ∅ = 3,0 mm; fio de Pt e Ag/AgCl, KCl (3,0 M) foram utilizados como eletrodos de trabalho, auxiliar e referência, respectivamente. Soluções estoque de HYTPHENYL a 0,25 mmol L-1 e de HTMCX a 30 mmol L-1 foram preparadas, armazenadas em frascos âmbar para evitar a degradação fotoquímica e mantidas sob refrigeração. Os processos de oxidação foram executados, por meio da adição de 1000 μL da solução estoque 0,25 mmol L-1 de HYTPHENYL ou 3,0 mmol L-1 de HTMCX à uma célula eletroquímica contendo 9,00 mL de soluções tampão Sorensen (0,067 mol L-1 de Na2HPO4 + 0,067 mol L-1 de KH2PO4, pH = 6,96) ou Fosfato 0,20 mol L-1 (0,20 mol L-1 de Na2HPO4 + 0,20 mol L-1 de NaH2PO4.H2O, pH = 7,14) recém-preparadas. A técnica utilizada nesse estudo foi a voltametria cíclica e os voltamogramas foram registrados numa janela de potencial de – 400 a 1200 mV e a velocidade de varredura foi variada de 10 a 100 mVs-1. Durante os registros voltamétricos, N2 gasoso foi usado para purgar o gás O2 das soluções. Todas as medidas foram registradas em triplicata à temperatura ambiente (25 ± 1oC) e a média dos valores foi considerada para posteriores cálculos.
Resultado e discussão
Para os dois compostos foram registrados um único pico de oxidação em
potenciais bem positivos, que não desapareceu e a corrente de pico não
diminuiu. Em todos os voltamogramas registrados, os resultados obtidos com
ECV na presença de HYTPHENYL e HTMCX foram comparados aos registrados nos
brancos (tampões), sob as mesmas condições. O comportamento voltamétrico do
HYTPHENYL foi estudado por voltametria cíclica sobre ECV, por tratar-se do
eletrodo de trabalho utilizado em estudos análogos (MANNINO et al, 1998). Em
tampão Sorensen (pH 6,96) e no intervalo de velocidade varredura (υ): 10,0 a
100 mVs-1, a chalcona derivada HYTPHENYL e a acetofenona natural
HTMCX produziram um pico anódico bem definido em aproximadamente
Epa = 650 mV e Epa = 920 mV, respectivamente, no
primeiro ciclo de varredura. O processo de oxidação é irreversível, pois não
nenhum pico catódico é registrado na varredura reversa. Na otimização do
eletrólito suporte a ser utilizado no estudo do comportamento eletroquímico
do HYTPHENYL, voltamogramas cíclicos foram registrados em dois tampões com
pHs próximos de 7,00: Sorensen (pH 6,96) e Fosfato 0,20 mol L-1
(pH 7,14) e observa-se que os potenciais de pico anódico são muito próximos:
Epa = 650 e 690 mV, respectivamente. Entretanto, a corrente
registrada em tampão Sorensen (pH 6,96) é cerca de 4 vezes à do tampão
Fosfato (pH 7,14), isto provavelmente se deve ao uso de excesso desse
eletrólito suporte, pois a concentração iônica é 8000 vezes maior que a
concentração da espécie eletroativa de interesse, impedindo a formação do
campo elétrico devido ao gradiente de cargas (AGOSTINHO et al, 2004). Como
relatado anteriormente, a primeira varredura de cada voltamograma cíclico
para o HYTPHENYL apresenta um pico de oxidação bem definido registrado em
Epa = 650 mV, enquanto que o potencial de meia onda
(E1/2, no qual a corrente equivale à metade da corrente
registrada em Epa foi igual a 41 mV. Porém a partir do segundo
ciclo de varredura, outro pico de oxidação (Epa1) é registrado em
0,12 V e a corrente anódica registrada em Epa é diminuída. Na
varredura reversa, um pico de redução aparece em Epc = 60 mV.
Entretanto, se a segunda varredura não é executada, nenhum outro pico de
oxidação é registrado entre os potenciais de –0,40 e 1,0 V, indicando que o
produto final da oxidação observado em Epa1 está relacionado à
espécie reduzida em Epc, Figura 2. O número de elétrons
envolvidos no processo redox registrado em Epa pode ser estimado a partir de
um gráfico da função de corrente (Ψ) experimental versus velocidade de
varredura (BARD & FAULKNER, 2001; TORRIERO et al, 2006). A Ψ experimental é
definida como Ψ = Ip/(A υ1/2 C), onde: A é a área do
ECV (0,071 cm2), υ a velocidade de varredura (V s-1) e
C a concentração de HYTPHENYL (89 μmol L-1). O resultado obtido
de Ψ para diferentes velocidades de varredura foi Ψ = 1,1 A (V/s)
-1/2 cm-2 L mol-1. O número estimado (com
10% de erro) de elétrons envolvidos no processo eletródico global pode ser
calculado, comparando-se o valor experimental com os valores obtidos para o
mesmo tipo de eletrodo e nas mesmas condições para compostos modelos que
trocam um ou dois elétrons. Soluções de K4[Fe(CN)6]
4,0 mmol L-1 e de 1,4‐hidroquinona 0,30 mmol L-1 foram
utilizadas como modelos para processos envolvendo 1 elétron: Ψ = 0,68 A
(V/s-1/2 cm-2 L mol-1 e 2 elétrons: Ψ = 1,4
A (V/s)-1/2 cm-2 L mol-1, respectivamente.
O valor de Ψ ≅ 1,1 A (V/s)-1/2 cm-2 L mol-1
indica que o processo geral de eletrodo para o HYTPHENYL envolve 2 elétrons.
Estes dados indicam que em tampão Sorensen (pH 6,96) a oxidação do HYTPHENYL
compreende duas transferências sucessivas de 1 elétron num mesmo potencial.
Então, como Eo1 ≅ Eo2, apenas um
pico é detectado na primeira varredura anódica (POLCYN; SHAIN, 1966). O
mecanismo de oxidação proposto para o HYTPHENYL envolve a formação de um
radical fenoxil resultante da retirada de 1 elétron do grupo 2’-hidroxila
seguido da abstração de 1 íon H+. Na sequência, esse radical
fenoxil muito provavelmente forma um dímero (COTELLE et al, 2005). A
introdução de outro anel aromático (anel B) na estrutura do HTMCX parece
facilitar a oxidação do HYTPHENYL, pois este composto é mais facilmente
oxidado (Epa = 670 mV) do que o HTMCX (Epa = 920 mV).
Uma explicação plausível para esta observação é que a presença de um grupo
doador de elétrons, o fenil (anel B) aumenta a densidade eletrônica do anel
A, intensificando assim a força da ligação de hidrogênio entre o grupo
hidroxila e o oxigênio do grupo carbonila, dificultando a retirada do
hidrogênio, Figura 1. Finalmente, é possível afirmar que o processo de
oxidação do HYTPHENYL sobre ECV foi controlado por difusão, pois o gráfico
da corrente de pico anódico (Ipa) em função da raiz quadrada da
velocidade de varredura apresentou boa linearidade (r2 = 0,9968).
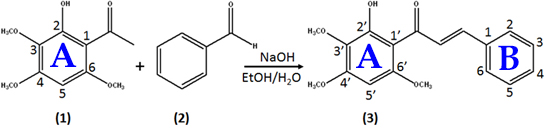
Esquema da síntese da chalcona HYTPHENYL.
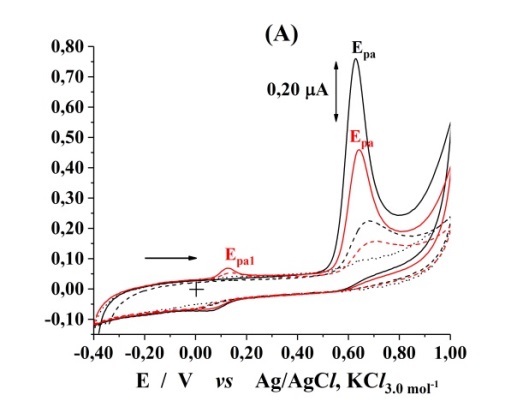
Voltamogramas cíclicos registrados sobre ECV: HYTPHENYL 25 microM: em Fosfato (pH 7,14), 1º (-.-); 2º (-.-) em Sorensen (pH 6,96), 1º (_); 2º (_).
Conclusões
O comportamento voltamétrico apresentado em meio misto (10% etanol + 90% tampão aquoso) pela nova chalcona sintetizada, o HYTPHENYL, apontou na primeira varredura um único pico anódico (Epa) bem definido em 650 mV, porém a partir da segunda varredura, outro pico de oxidação (Epa1) é registrado em potencial menos positivo (120 mV) e com respectiva diminuição da corrente registrada em Epa. A varredura reversa indica que produto da oxidação formado em Epa1 é reduzido em Epc e o valor da função de corrente = 1,1 A (V/s)-1/2 cm-2 L mol-1 indica que o mecanismo de oxirredução do HYTPHENYL envolve 2 elétrons, num processo irreversível que compreende duas transferências sucessivas de 1 elétron no mesmo potencial, haja vista a detecção de apenas um pico na primeira varredura anódica. Estes resultados justificam a necessidade de realização de estudos eletroquímicos em meio aprótico para o HYTPHENYL, uma vez que outros análogos deste poderão ser comparados sob o ponto de vista de seus comportamentos físico-químico e biológicos.
Agradecimentos
Ao CNPq, FINEP e FUNCAP: PQ/CNPq-2015 (303963/2015-8); PQ-BPI/FUNCAP (BP2- 0107- 00026.01.00/15) e PRONEX FUNCAP/CNPq (PR2-0101-00006.01.00/15). Ao CENAUREM pela obten
Referências
ABU, N.; HO, W.Y.; YEAP, S.K.; AKTHAR, M.N.; ABDULLAH, M.P.; OMAR, A.R.; ALITHEEN, N.B. The flavokawains: uprising medicinal chalcones. Cancer Cell International, v. 13, n. 1, p. 102, 2013. AGOSTINHO, S.M.L.; VILLAMIL, R.F.V.; AGOSTINHO NETO, A.; ARANHAN, H. O Eletrólito Suporte e suas Múltiplas Funções em Processos de Eletrodo. Química Nova, v. 27, n. 5, p. 813-817, 2004. BERAR, U. Chalcones: compounds possessing a diversity in applications. Orbital – The Electronic Journal of Chemistry, v. 4, n. 3, p. 209-221, 2012. CHIARADIA, L.D.; SANTOS, R. VITOR, C.E.; VIEIRA, A.A.; LEAL, P.C.; NUNES, R.J.; CALIXTO, J.B.; YUNES, R.A. Synthesis and pharmacological activity of chalcones derived from 2,4,6-trimethoxyacetophenone in RAW 264.7 cells stimulated by LPS: Quantitative structure–activity relationships. Bioorganic & Medicinal Chemistry, v. 16, p. 658-667, 2008. COTELLE, N.; HAPIOT, P.; PINSON, J.; ROLANDO, C.; VEZIN, H. Polyphenols Deriving from Chalcones: Investigations of Redox Activities. Journal of Physical Chemistry B, v. 109, p. 23720-23729, 2005. MANNINO, O.; BRENNA, S.; BURATTI, S.; COSIO, M.S. A New Method for the Evaluation of the ‘Antioxidant Power’ of Wines. Electroanalysis, v. 10, p. 908-912, 1998. OLIVEIRA, M.T.A.; TEIXEIRA,, A.M.R. COUTINHO, H.D.M.; MENEZES, I.R.A.; SENA JR., D.M.; SANTOS, H.S.; MESQUITA, B.M. ALBUQUERQUE, M.R.J.R.; BANDEIRA, P.N.; BRAZ-FILHO, R. Identification and Modulatory Activity Assessment of 2-Hydroxy-3,4,6-trimethoxyacetophenone Isolated from Croton anisodontus Mull. Arg.(Euphorbiaceae), Natural Product Communication, v. 9, n. 05, p. 665-668, 2014. POLCYN, D.S.; SHAIN, I. Multistep Charge Transfers in Stationary Electrode Polarography. Analytical Chemistry, v. 38 p. 370-375, 1966. SINGH, P.; ANAND, A.; KUMAR, V. Recent developments in biological activities of chalcones: A mini review. European Journal of Medicinal Chemistry, v. 85, p. 758-777, 2014. TORRIERO, A.A.J.; TONN, C.E.; SERENO, L.; RABA, J. Electrooxidation mechanism of non-steroidal anti-inflammatory drug piroxicam at glassy carbon electrode. Journal of Electroanalytical Chemistry, v. 588, p. 218-225, 2006. WANG, Z. Comprehensive Organic Name Reactions and Reagents. New York: John Wiley and Sons, Inc., 2009.











