Detecção voltamétrica de peróxido de hidrogênio (H2O2), utilizando a Hemoglobina extracelular gigante de Glossoscolex Paulistus (HbGp) como elemento de biorreconhecimento
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Nascimento, E.D. (UNIFESSPA) ; Oliveira, T.M.B.F. (UFCA) ; Carvalho, F.A.O. (UNIFESSPA)
Resumo
O referente trabalho tem por objetivo utilizar a HbGp como elemento de biorreconhecimento para H2O2. Os experimentos voltamétricos foram realizados sobre eletrodo de trabalho (HbGp/Nafion®/ECV) em tampão fosfato pH 7,0. Os resultados da voltametria cíclica indicam que o processo redox é de natureza quase-reversível e governado por difusão das moléculas, onde está associado a troca eletrônica do Fe2+/Fe3+ nos centros porfirínicos. Para voltametria de onda quadrada, frequência de 150 s-1, amplitude de 30 mV e 3 mV de incremento foi construída a curva analítica na faixa de concentração de 7,94 × 10-6 a 3,84 × 10-5 mol L-1, com r=0,9954 e o limite de detecção de 3,78×10-6 mol L-1, logo tem-se elevada sensibilidade, precisão e confiabilidade do sistema para detecção de níveis baixos do analito
Palavras chaves
Técnicas voltamétricas; HbGp; H2O2
Introdução
O desenvolvimento de métodos analíticos baratos, simples e de rápida análise é um grande desafio em diferentes áreas da ciência, e continua sendo o foco de muitas pesquisas atualmente. Nos últimos anos houve uma grande expansão nos estudos eletroquímicos para quantificação de diferentes analitos, utilizando principalmente biomoléculas para este fim (SILVEIRA, 2012). Atualmente tem-se um crescente interesse em estudar hemoglobinas extracelulares gigantes, que pode ser explicado pela alta estabilidade dessas proteínas quando submetidas à condições de stress, resistência à auto-oxidação, elevada cooperatividade e afinidade para ligar-se ao oxigênio, conferindo às mesmas um grande potencial para aplicações biotecnológicas (HARNOIS et al, 2009) A hemoglobina extracelular gigante de Glossoscolex paulistus (HbGp; Figura 1), por exemplo, possui uma estrutura oligomérica altamente organizada, formada por 144 cadeias polipeptídicas com grupo heme (parte eletroativa desta classe de proteína; Figura 2) e 36 cadeias polipeptídicas sem grupos heme, denominadas de cadeias linker (ROYER et al, 2001). Além disso, um estudo recente mostrou que a HbGp possui expressiva atividade para peroxidase na presença do guaiacol e, portanto, catalisa a redução do peróxido de hidrogênio (CARUSO et al, 2016). Logo o presente trabalho apresenta um estudo voltamétrico da HbGp, através das técnicas de voltametria cíclica e voltametria de onda quadrada, para utilizar a mesma como elemento de biorreconhecimento para peróxido de hidrogênio
Material e métodos
4.1 Reagentes e Soluções Todos os reagentes utilizados foram de pureza analítica (P.A.). A Solução do eletrólito de suporte, tampão fosfato pH 7,0, com 0,1 mol L-1, a solução estoque da HbGp com 20 mg/mL, a solução estoque do H2O2 com 1,0×10-3 mol L- 1. 4.2 Instrumentações Os experimentos foram realizados em uma célula convencional, com três eletrodos: O eletrodo de trabalho de Carbono Vítreo, tendo a HbGp como elemento de biorreconhecimento, um eletrodo de platina como eletrodo auxiliar e um eletrodo de Ag/AgCl/Cl-sat como referência. Este conjunto foi conectados a um potenciostato modelo μ-Autolab (Type III, Methrom) e controlados por computador, por meio do software NOVA 1.10. 4.3 Metodologia eletroanalítica As informações relacionadas a eletroatividade do sistema, foram avaliadas com base nos valores de corrente de pico (Ip), potencial de pico (Ep) e potencial de pico a meia-onda (Ep1/2), que controlam a sensibilidade e seletividade da técnica. As informações qualitativas da HbGp foram obtidas pela técnica de voltametria cíclica (VC), tomando por base a razão sinal/ruído. Para a quantificação utilizou-se a Voltametria de Onda Quadrada (VOQ), que após a otimização dos parâmetros que controlam a sensibilidade da técnica: frequência (ƒ), amplitude (a) e incremento (ΔEs), foi construída uma curva analítica para o H2O2 na faixa de concentração de 7,94 x 10-6 a 3,84 × 10-5 mol L-1, a partir da relação entre Ip e [H2O2]. 4.4 Modificação do Eletrodo HbGp/Nafion®/ECV Para suportar a hemoglobina na superfície do ECV foi adicionado 20 μL de nafion® sobre a área eletroativa do eletrodo e aguardou-se por 20 minutos para secagem. Em seguida, adicionou-se 20 μL da HbGp, deixando em repouso por mais 20 minutos para secagem e depois realizou-se a leitura.
Resultado e discussão
A eletroatividade da HbGp foi avaliada em meio de solução tampão fosfato (pH
7,0), utilizando VC a 100 mV s-1, o êxito na imobilização da proteína foi
caracterizado por um par-redox quase-reversível (pico anódico em +
1,051 V e pico catódico em +0,213 V vs. Ag/AgCl/Cl-saturado), associado aos
processos de troca eletrônica do sistema Fe2+/Fe3+ nos centros porfirínicos,
obtendo assim ΔEp de 838 mV, Na presença de H2O2 (1,00×10-5 mol L-1), o
sinal característico do biossensor HbGp/Nafion®/ECV diminui expressivamente,
mostrando indícios de inativação da proteína de trabalho. Investigando o
sistema em diferentes velocidades de varredura (10-250 mV s-1), foi
verificada uma relação linear entre as correntes de pico e a raiz quadrada
desta variável para ambos os processos, indicando cinética eletródica rápida
e que a velocidade de transferência de elétrons supera a difusão do analito
na interface biossensor/solução. Para a quantificação do H2O2, utilizou-se
voltametria de onda quadrada, após a otimização dos parâmetros que
influenciam o sinal eletroquímico nesta técnica (pulsos de potencial com 150
s-1 de frequência, 30 mV de amplitude e 3 mV de incremento). Observando a
faixa linear da curva analítica (2,10×10-6 a 3,84×10-5 mol L-1), o
coeficiente de correlação (r = 0,9954) e o limite de detecção alcançado
(3,78×10-6 mol L-1), pode-se constatar a elevada sensibilidade, precisão e
confiabilidade de HbGp/Nafion®/ECV para quantificar baixos níveis do
analito.
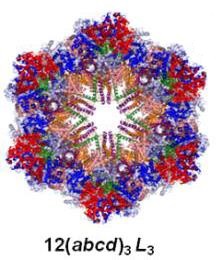
Representação geral da HbGp
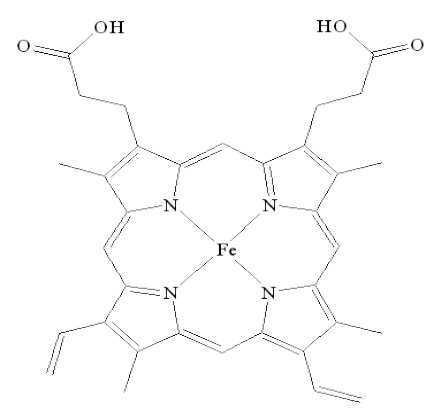
Centro porfirínico do grupo heme
Conclusões
Estudos qualitativos por voltametria cíclica, indicam que a eletroatividade da HbGp sobre o eletrodo de Carbono Vítreo modificado com nafion® é caracterizado por um processo quase-reversível, associado a troca eletrônica do sistema Fe2+/Fe3+ nos centros porfirínicos. Nos fenômenos de superfície, o transporte de massa era controlado por difusão, sem fenômenos de adsorção de reagentes e/ou produtos. Após a otimização dos parâmetros (f = 150 s-1, a = 30 mV, ΔEs = 3 mV), foi possível detectar o analito com LD = 3,78×10-6 mol L-1. Comprovando a eficiência do método proposto para detecção do H2O2
Agradecimentos
À CAPES pelo auxílio concedido ao projeto
Referências
CARUSO, C. S.; BIAZIN, E.; CARVALHO, F. A.; TABAK, M.; BACHEGA, J. F. Metals content of Glossoscolex paulistus extracellular hemoglobin: Its peroxidase activity and the importance of these ions in the protein stability. J Inorg Biochem. Aug;16:63-72, 2016.
HARNOIS, T.; ROUSSELOt, M.; ROGNIAUX, H.; ZAL, F. High-level production of recombinant Arenicola marina globin chains in Escherichia coli: a new generation of blood substitute. Artif Cells Blood Substit Immobil Biotechnol. 37(3):106-16, 2009.
ROYER, W.E.; KNAPP, J. E.; STRAND, K.; HEASLET, H. A. Cooperative hemoglobins: Conserved fold, diverse quaternary assemblies and allosteric mechanisms. Trends in Biochemical Sciences, 26:297–304, 2001.
SILVEIRA, L. T. Estudo eletroquímico da interação do citocromo C com liquidos iônicos em diferentes substrates para aplicação em biossensores. [Tese de doutorado], Universidade de São Paulo, 2012.











