CROMATOGRAFIA IÔNICA COMO ALTERNATIVA PARA A DETERMINAÇÃO SIMULTÂNEA DE CITRATO E FOSFATO EM SOLUÇÕES ANTICOAGULANTES DE BOLSAS DE SANGUE
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Cruz, G.C.S. (INCQS - FIOCRUZ) ; Fust, A.M.B.S. (INCQS - FIOCRUZ) ; Venâncio, L.F. (INCQS - FIOCRUZ) ; Vale, R.F.D. (INCQS - FIOCRUZ) ; Silva, F.S.Q. (INCQS - FIOCRUZ) ; Feitoza-silva, M. (INCQS - FIOCRUZ)
Resumo
O objetivo deste estudo foi realizar a otimização e avaliar a implementação de um novo método para a determinação de citrato total e fosfato diácido de sódio monohidratado. Para a otimização da metodologia analítica foram estudados os parâmetros do método proposto e realizada a validação. Na avaliação dos resultados foram observadas variações de condições analíticas específicas para fase móvel, temperatura e curva analítica. Observou-se que os resultados (seletividade/especificidade, linearidade, limite de detecção e quantificação, precisão, exatidão e robustez) indicaram que o novo método é reprodutível. O estudo permitiu apresentar os aspectos relevantes da implementação do método alternativo, principalmente, por permitir determinar simultaneamente os analitos de interesse.
Palavras chaves
Bolsas de sangue; Solução anticoagulante; CLAE
Introdução
A bolsa de sangue, conforme estabelecido na norma ISO 3826-1/2013, é um produto que consiste em bolsas plásticas e estéreis, completas com tubo de coleta, tubos de saída, tubos de transferência, agulha para coleta e recipientes associados, no qual, depende da sua finalidade. São produtos de alta complexidade, classificados como risco III, de acordo com a RDC nº 185 de 2001. Estas se destinam a coleta armazenamento, processamento, separação, administração e transporte do sangue e suas frações de forma eficiente e segura (BRASIL, 2001; ISO, 2013). As bolsas de sangue podem ser do tipo seca, ou seja, bolsas de sangue sem solução anticoagulante ou com solução anticoagulante (VALE, 2010). A referência nacional para análises deste produto é o Instituto Nacional de Controle de Qualidade em Saúde (INCQS/FIOCRUZ), responsável pelas análises prévias ao registro. Os parâmetros de controle da qualidade deste produto estão inseridos no ato normativo da Anvisa RDC n° 35 de 2014 que substituiu a Portaria nº 950 de 26 de novembro de 1998, onde está descrito as metodologias que foram avaliadas, otimizadas e validadas (BRASIL, 1998; VALE, 2010; BRASIL, 2014). Esta legislação preconiza os requisitos mínimos de qualidade para este artigo de saúde através de parâmetros de controle biológicos, físicos e físico- químicos. Dentre os parâmetros físico-químicos recomendados, está a determinação de citrato total e do fosfato diácido de sódio monohidratado nas soluções anticoagulantes. As soluções anticoagulantes presentes em bolsas de sangue têm como finalidade manter a qualidade do sangue e suas frações, durante o período de armazenamento (VALE, 2010; FREITAS et al, 2016). A principal característica da bolsa de sangue consiste no tipo de solução anticoagulante que apresenta e estas soluções diferem nos componentes que possuem e no tempo de conservação do sangue (VALE, 2010; ISO, 2013). A associação do citrato de sódio com o ácido cítrico atua como uma solução tampão, tendo como função prevenir mudanças bruscas no pH de modo a manter a viabilidade de cada constituinte sanguíneo. Esta combinação está presente em bolsas de sangue contendo soluções do tipo: ACD, de composição citrato-dextrose; CPD que apresenta na sua composição citrato- fostato-dextrose e CPDA de composição citrato-fostato-dextrose-adenina (VALE, 2010; FERNANDES et al, 2016). O citrato de sódio é um quelante de cálcio que reage com o cálcio livre do sangue formando sais insolúveis. A ausência de cálcio livre impede a efetivação do mecanismo de coagulação sanguínea. O citrato de sódio não preserva os eritrócitos, portanto, o sangue deve ser utilizado em até 24 horas após a coleta (HOFFBRAND, 2013). A determinação de citrato apresenta-se em termos de citrato total, pois, a Resolução RDC nº 35/2014 recomenda a metodologia do teor de citrato total, ou seja, o somatório de citrato de sódio e ácido cítrico livre. O método para determinação desse teor avaliado neste estudo utiliza a técnica de cromatografia líquida de alta eficiência com detecção ultravioleta (CLAE/UV) (BRASIL, 2014). O fosfato diácido de sódio monohidratado, além de ser substrato para formação do 2,3-DPG, atua como um tampão ligando-se aos íons H+ produzidos durante a glicólise e impedindo a queda do pH que é o principal fator relacionado com a degradação do 2,3-DPG. Consequentemente, tem-se uma menor taxa de hemólise e uma maior viabilidade celular. A Resolução RDC nº 35/2014 recomenda a utilização da metodologia descrita na Farmacopeia Americana. O método para determinação do teor de fosfato diácido de sódio monohidratado utiliza a técnica de espectrofotometria (BRASIL, 2014). A qualidade e a segurança indispensáveis aos produtos devem ser avaliadas pelo cumprimento de quesitos de conformidade, eficácia, efetividade e desempenho no momento da fabricação e da utilização. A legislação brasileira específica que os produtos para a saúde, quando utilizados nas condições e finalidades previstas não devem comprometer a saúde dos pacientes e dos operadores do produto (ANVISA, 2010). As bolsas de sangue são materiais adquiridos pelo MS, sendo considerados insumos estratégicos para o SUS. O regulamento técnico para Boas Práticas de Fabricação (BPF) de bolsas de sangue estabelece que a comprovação da eficácia e da segurança de bolsas de sangue seja realizada pelo INCQS (ANVISA, 2010). Nesta atuação, como laboratório de referência nacional, o INCQS realiza análises para fins de controle sanitário em bolsas de sangue o que indica a necessidade da comprovação de sua competência técnica na produção de resultados confiáveis e rastreáveis no controle da qualidade das bolsas de sangue. Este trabalho tem como objetivo a otimização e validação de um novo método para determinação simultânea de citrato total e fosfato diácido de sódio monohidratado em soluções anticoagulantes de bolsas de sangue, buscando melhores resultados, em termos de reprodutibilidade e tempo de análise.
Material e métodos
Os parâmetros do método proposto foram estudados utilizando o padrão analítico secundário recém-preparado no laboratório, pré-qualificado por avaliação de teor. Todas as soluções foram preparadas utilizando água ultrapurificada, obtida pelo sistema de purificação Millipore®. As determinações analíticas foram efetuadas em um cromatógrafo iônico Dionex®. A separação dos analitos foi realizada utilizando a coluna cromatográfica Dionex Ionpac® AS11. No preparo da fase móvel foi utilizado 1,05 mL de solução de hidróxido de sódio 50% da Merck e transferiu-se para balão volumétrico de 1000 mL com água ultrapurificada para obter uma concentração de 20 mM, posteriormente, desgaseificada em banho de ultrassom, utilizou-se fluxo de 2,0 mL/minuto, temperatura do forno de 25 ºC e volume de injeção de 10 µL. No preparo da amostra pipetou-se 1,5 mL de amostra da solução anticoagulante CPD, adicionou-se 25 mL de fase móvel, transferiu-se para balão volumétrico de 500 mL e completou-se com água ultrapurificada. A injeção foi realizada em triplicata e para a obtenção do cromatograma foi necessário um tempo de corrida de 5 minutos (USP, 2016). A validação foi realizada com base nos parâmetros do protocolo proposto pela Anvisa e Inmetro (INMETRO, 2016; BRASIL, 2017). A seletividade da técnica foi comprovada através da comparação entre matrizes isentas do analito, matrizes contendo o analito e matrizes comerciais de soluções anticoagulantes. A linearidade foi avaliada pela construção de três curvas analíticas, contendo cinco níveis de concentração de citrato e fosfato, com injeções em triplicata para determinação do citrato e fosfato utilizando a cromatografia iônica. A avaliação dos resultados foi feita utilizando a planilha desenvolvida por Souza & Junqueira, que permitiu determinar o limite de quantificação e o limite de detecção através da avaliação dos resíduos e a relação entre o desvio padrão da curva analítica e sua inclinação (coeficientes angular e linear). A precisão foi estudada nos níveis de repetibilidade e precisão intermediária. Os sinais cromatográficos obtidos permitiram determinar o desvio padrão relativo (DPR) (USP, 2016). A precisão intermediária foi realizada sob as mesmas condições cromatográficas da repetibilidade, alterou-se três analistas, em três dias diferentes. Os dados cromatográficos foram avaliados pelo DPR. A exatidão do método foi realizada pelo mecanismo de determinação da recuperação através de injeções das soluções de trabalho na elaboração da curva de adição padrão de citrato e fosfato, segundo Horwitz. A robustez do método foi avaliada analisando três replicatas do padrão de calibração do nível intermediário da curva analítica, variando as seguintes condições experimentais: fase móvel (fluxo e concentração), volume de injeção e coluna cromatográfica, conforme preconizado pelo teste de Youden para as combinações estabelecidas das alterações analíticas, admitindo ainda dois níveis de variações.
Resultado e discussão
Este estudo teve o intuito de otimização das condições experimentais e a
determinação dos parâmetros de validação do método de cromatografia iônica
para determinação simultânea de citrato total e fosfato diácido de sódio
monohidratado em soluções anticoagulantes de bolsas de sangue. A partir da
busca realizada no sistema Harpya (Sistema Web de Gerenciamento de Amostras
Laboratoriais) do INCQS, foram observadas que as bolsas de sangue, contendo
solução anticoagulante CPD possuem um quantitativo superior que as bolsas de
sangue CPDA. Portanto, a solução CPD foi escolhida, por representar o tipo
de maior prevalência de análises realizadas no período selecionado de 2012 a
2016, obedecendo aos critérios: resultado satisfatório, integridade da
amostra, prazo de validade e disponibilidade no setor. A seletividade do
método foi demostrada através da comparação dos cromatogramas da amostra
comercial, amostra preparada sem autoclavação e amostra preparada com o
processo de autoclavação. Ao analisar os sinais cromatográficos, observou-se
a simetria e a distinção entre as duas substâncias. Na comparação do placebo
sem autoclavação e placebo com autoclavação foi verificado que não houve
degradação com a autoclavação e, além disso, não ocorreu a formação de
compostos que possam eluir junto com o citrato ou fosfato. Logo, o método
foi seletivo, visto que não existem substâncias próximas ao tempo de
retenção dos analitos (MARQUES et al, 2012). Na avaliação da especificidade,
a autoclavação das amostras foi escolhida como método de degradação por
corresponder a uma etapa do processo industrial. Observou-se os mesmos
perfis cromatográficos com tempo de retenção de ± 2,0 minutos para o fosfato
diácido de sódio monohidratado e ± 3,0 minutos para o citrato total,
constatando ausência de interferentes e/ou produtos de degradação na região
de interesse. A linearidade foi comprovada pela verificação da
homocedasticidade, obtenção de regressão linear significativa, ausência de
desvio de linearidade e comprovação da normalidade. De acordo com os testes
realizados, foi observado um coeficiente de correlação (r) de 0,9992 para o
citrato e 0,9988 para o fosfato, conforme estabelecido pela Anvisa (0,99)
(BRASIL, 2017) e pelo Inmetro (0,90) (INMETRO, 2016), comprovando a
satisfatoriedade do método para determinar citrato e fosfato diácido de
sódio monohidratado na matriz da solução anticoagulante. Os resultados
obtidos para o limite de detecção do citrato foi de 1,93 μg/mL e o limite de
quantificação de 5,75 μg/mL, para o fosfato diácido de sódio monohidratado o
limite de detecção encontrado foi de 0,563 μg/mL e o limite de quantificação
de 1,68 μg/mL obtidos pela planilha de avaliação da Linearidade de Curva
Analítica de Souza & Junqueira. A injeção de soluções contendo,
individualmente, cada um dos analitos de interesse deste método fez-se a
identificação específica dos sinais cromatográficos de fosfato e citrato,
respectivamente (FERNANDES et al, 2016). Na avaliação da linearidade do teor
de citrato, de acordo com a planilha Souza & Junqueira apresentou valores
extremos, porém, a linearidade não ficou comprometida pelo desvio
verificado. Este resultado demonstrou que o coeficiente de correlação (r) se
apresentou satisfatório (0,9992). A análise dos resíduos apresentou
resultado satisfatório pelo teste de Dubin Watson (autocorrelação),
verificou-se a homocedasticidade e a distribuição normal dos resíduos. A
regressão foi significativa (Figura 1) e o gráfico de resíduos apresentou
resultados dispersos numa faixa estreita de análise. Na avaliação da
linearidade do teor de fosfato diácido de sódio monohidratado, assim como
para o citrato, verificou-se valores extremos, que não comprometeram a
linearidade. O resultado demonstrou que o coeficiente de correlação (r) se
apresentou satisfatório (0,9988). A análise dos resíduos foi satisfatória
pelo teste de Dubin Watson (autocorrelação), verificou-se a
homocedasticidade e a distribuição normal dos resíduos. A regressão foi
significativa (Figura 2) e o gráfico de resíduos apresenta resultados
dispersos numa faixa estreita de análise. Na precisão, obteve-se resultados
aceitáveis. A avaliação da repetibilidade para o citrato total e o fosfato
diácido de sódio monohidratado indicou DPR experimental de 1,6% para o
citrato total e 1,9 % para o fosfato diácido de sódio monohidratado,
inferior ao limite estabelecido pela Anvisa (5%) e pelo Inmetro (2%). E no
estudo da precisão intermediária do citrato total e do fosfato ácido de
sódio monohidratado, a variabilidade de alguns parâmetros experimentais
(analista e dia de análise) indicou um DPR de 2,8% para o citrato total e
3,1% para o fosfato diácido de sódio monohidratado, também inferior e
conforme os critérios estabelecidos pela Anvisa (5%) e pelo Inmetro (4%). A
exatidão do método foi avaliada pela determinação da recuperação,
recomendado pela Anvisa e pelo Inmetro (BRASIL, 2003; INMETRO, 2016; BRASIL,
2017). As avaliações foram realizadas, isoladamente, para cada analito e foi
adotada a tabela de critério de aceitação para recuperação de acordo com o
Inmetro. Neste estudo, a recuperação apresenta-se relacionada com as
concentrações dos analitos, obtidas na etapa de repetibilidade, e
correspondente a (95-105%) para o analito citrato e (90-107%) para o analito
fosfato (INMETRO, 2016). A exatidão foi comprovada pelo cálculo da
recuperação do analito em cada nível da curva de adição padrão. Verificou-
se, que a recuperação dos analitos de interesse ficaram entre os limites
estabelecidos para o nível de concentração dos analitos em estudo (INMETRO,
2016), comprovando assim, adequada exatidão do método para os mesmos. Na
avaliação da robustez, os resultados demonstraram que o tempo de retenção,
fator de assimetria e a resolução foram os parâmetros de adequação que
apresentaram maiores alterações, verificado pela variabilidade dos
resultados em todas as combinações e pelos efeitos nas determinações dos
analitos. Os valores de DPR comprovaram que o método é robusto a pequenas
variações nas condições analíticas avaliadas mantendo sua exatidão e
precisão, e garantindo a confiabilidade dos resultados obtidos (RIBANI,
2004; MARKMAN et al, 2007; TEIXEIRA, 2008). Assim, a validação do método
deve garantir, através de dados experimentais, que este atende às exigências
das aplicações analíticas, assegurando a confiabilidade e reprodutibilidade
de resultados (OLIVEIRA et al, 2015; BRASIL, 2017).
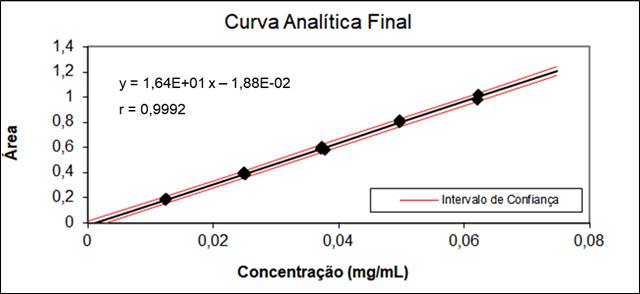
Representação gráfica da curva analítica do teor de citrato total resultante da avaliação da linearidade.
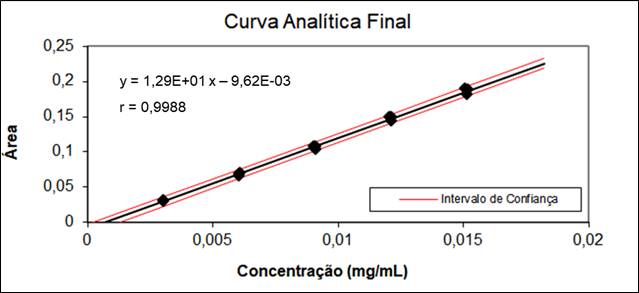
Representação gráfica da curva analítica do teor de fosfato diácido de sódio monohidratado resultante da avaliação da linearidade.
Conclusões
O estudo permitiu comparar as condições analíticas e apresentar os aspectos relevantes da implementação do método alternativo para a análise de citrato total e fosfato diácido de sódio monohidratado, simultaneamente, nas soluções anticoagulantes de bolsas de sangue. Os procedimentos analíticos para determinação de citrato total e fosfato diácido de sódio monohidratado por cromatografia iônica avaliados neste trabalho, apresentaram desempenho dentro das especificações preconizadas para os parâmetros da validação de métodos analíticos. Desta forma, os parâmetros seletividade e especificidade, linearidade, limite de detecção e limite de quantificação, precisão (repetibilidade e precisão intermediária), exatidão e robustez indicaram que o método é reprodutível. Portanto, contribui para melhorias no controle deste produto e evidencia a importância do INCQS na regulação deste, e ainda configura a necessidade da garantia de resultados exatos e confiáveis, de forma a reduzir o risco à saúde, colaborando para as atividades de monitoramento do controle da qualidade do produto bolsa de sangue. Ainda, contribui para a revisão da legislação vigente, provavelmente, para 2019 que contemplará o novo método. E, ressalta a importância da validação analítica para assegurar a qualidade não só de bolsas de sangue, mas também de produtos de âmbito sanitário, principalmente, disponibilizados pelo Ministério da Saúde, garantindo produtos seguros e eficazes à população brasileira. Além disso, sugere novos avanços no controle da qualidade deste produto e reitera a participação do INCQS em aspectos regulatórios de âmbito sanitário, utilizando metodologia analítica confiável e reprodutível sob as regras de validação analítica da legislação vigente.
Agradecimentos
Os autores agradecem ao Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz ao suporte financeiro para realização deste estudo. A equipe do laboratório pela parceria na execução deste trabalho.
Referências
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Manual de tecnovigilância: abordagens de vigilância sanitária de produtos para a saúde comercializados no Brasil. Brasília, 2010. 629 p.
BRASIL. Ministério da Saúde. Secretaria de Vigilância Sanitária. Portaria no 950, de 26 de novembro de 1998. Anexo. Regulamento técnico sobre bolsas plásticas para a coleta e acondicionamento de sangue humano e seus componentes. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília, DF, 30 nov. 1998.
BRASIL. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 185, de 22 de outubro de 2001. Aprova o Regulamento Técnico que consta no anexo desta Resolução, que trata do registro, alteração, revalidação e cancelamento do registro de produtos médicos na Agência Nacional de Vigilância Sanitária - Anvisa. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília, DF, 24 out. 2001.
_______. Resolução RDC n° 899, de 29 de maio de 2003. A diretoria colegiada da Agência Nacional de Vigilância Sanitária aprova o Guia para validação de métodos analíticos e Bioanalíticos. Diário Oficial da República Federativa do Brasil, Brasília, DF, Seção 1, 2 de junho de 2003.
_______. Resolução nº 35, de 12 de junho de 2014. Dispõe sobre bolsas plásticas para coleta, armazenamento e transferência de sangue humano e seus componentes. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília, DF, 02 jun. 2014.
_______. Resolução RDC no 166, de 24 de julho de 2017. Dispõe sobre a validação de métodos analíticos e dá outras providências. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília, DF, 11 jul. 2017.
FERNANDES, F. S.; VALE, R. F. D.; FUST, A. M. B. S.; FREITAS, M. N. M.; GUIMARÃES, R. S. F.; TEIXEIRA, M. T; FEITOZA-SILVA, M.; JACOB, S. C. Validação da metodologia para a determinação de Citrato total em soluções anticoagulantes de bolsas de sangue por cromatografia líquida de alta eficiência. Rev. Virtual Quim. v. 8, n. 5, p. 1476-1484, 2016.
FREITAS, M. N. M.; VALE, R. F.D.; FUST, A. M. B.F.; FERNANDES, F. S; FEITOZA-SILVA, M.; LEANDRO, K. C. Otimização e Validação da Metodologia para a Determinação de 5-Hidroximetilfurfural em Soluções Anticoagulantes e Preservadoras de Bolsas de Sangue por Cromatografia Líquida de Alta Eficiência. Rev. Virtual Quim. v. 8, n. 5, p. 665-677, 2016.
HOFFBRAND, A. V. Fundamentos em hematologia. 6. ed. Porto Alegre: Artmed, 2013.
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA. Orientações sobre validação de métodos analíticos. Documento de caráter orientativo. Rio de Janeiro. 2016.
INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 3826-1: plastics collapsible containers for human blood and blood components - part 1: conventional containers. Switzerland, 2013.
MARKMAN, B. E. O.; KOSCHTSCHAK, M. R. W.; AURICCHIO, M. T. Otimização e validação de método farmacopeico para verificar possíveis desvios de qualidade de matérias primas e cápsulas manipuladas contendo hormônios tireoidianos. Rev. Inst. Adolfo Lutz, v. 66, n. 3, p. 268-274, 2007.
MARQUES, G.S.; MONTEIRO, R. P.; LEÃO, W. F.; LYRA, M. A.; PEIXOTO, M. S.; NETO, P. J. R.; XAVIER, H. S.; SOARES, L. A. L. Avaliação de procedimentos para quantificação espectrofotométrica de flavonoides totais em folhas de Bauhinia forficata link. Quim. Nova, v. 35, n. 3, p. 517-522, 2012.
OLIVEIRA, C.M.R.C.M.; CARDOSO, K.M.; SOUZA M.M.; SANTOS J.S.; SANTOS MLP. Validação de um método prático para determinação de níveis de amoxicilina em águas naturais por CLAE-UV e sua aplicação na qualidade ambiental. Rev Inst Adolfo Lutz. São Paulo, v. 74, n. 4, p. 361-70, 2015.
RIBANI, M. et al. Validação em métodos cromatográficos e eletroforéticos. Química Nova, São Paulo, v. 27, n. 5, p. 771-780, 2004.
TEIXEIRA, A. S. Adequação e apresentação de parâmetros de validação intralaboratorial de um ensaio para a quantificação de aflatoxinas em Castanha-do-Brasil (Bertholletia Excelsa Bonpl.) através de cromatografia líquida de alta eficiência. 2008. 57 f. Dissertação (Mestrado) – Universidade Federal Rural do Rio de Janeiro, Rio de Janeiro, 2008.
USP. THE UNITED STATES PHARMACOPEIA 39. National formulary 34. Rockville: U.S. Pharmacopeia, 2016. 2 v.
VALE, R. F. D. Avaliação de metodologias preconizadas no controle de qualidade físico-químico de bolsas de sangue. 2010. 106 f. Trabalho de Conclusão de Curso (Especialização em Controle da Qualidade de Produtos, Ambientes e Serviços Vinculados à Vigilância Sanitária) – Instituto Nacional de Controle de Qualidade em Saúde, Fundação Oswaldo Cruz, Rio de Janeiro, 2010.











