DESENVOLVIMENTO DE PLATAFORMA NANOESTRUTURADA A BASE DE NANOTUBOS DE CARBONO E CAPSAÍCINA PARA DETERMINAÇÃO E QUANTIFICAÇÃO DE ÁCIDO ASCORBICO
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Santos, D.D.E.R. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Maciel, H.S. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Santos, N.D. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Silva, L.V. (INSTITUTO FEDERAL DE ALAGOAS) ; Almeida, A.K.A. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Xavier, A.F.A. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Goulart, M.O.F. (UNIVERSIDADE FEDERAL DE ALAGOAS)
Resumo
Os Fenóis detém atividade antioxidante e sua eletroxidação em eletrodos modificados com nanotubos de carbono leva à formação de polímeros com pares redox reversíveis, que são mediadores gerados da polimerização da capsaícina na determinação de biomoléculas. Como o ácido L-ascorbico (AA) possui um papel essencial no funcionamento do metabolismo humano, é importante a criação de sensores que possuam alta sensibilidade e estabilidade para determinação de AA. O comportamento eletroquímico dos eletrodos modificados foi estudado empregando as técnicas de voltametria cíclica e cronoamperometria. Este trabalho traz o desenvolvimento de um eletrodo quimicamente modificado com nanotubos de carbono (MWCNT) e polímero de capsaícina (CAP) gerado eletroquimicamente (poli-CAP) para deteterminação de AA.
Palavras chaves
Eletroquímica; Sensores; Eletroanalítica
Introdução
Os eletrodos eletroquímicos podem apresentar superfícies modificadas, no intuito de melhorar as respostas eletroquímicas, em relação àquelas obtidas em eletrodos convencionais. Os principais interesses são aumento de seletividade, sensibilidade, estabilidade química e eletroquímica, bem como, uma maior janela de potencial e resistência à adsorção de interferentes, juntamente com estudos fundamentais para a compreensão dos processos interfaciais. É preciso de melhorar o desempenho dos eletrodos e de projetar interfaces, de forma racional. Mediadores geralmente são compostos que são adsorvidos na superfície do eletrodo ou em uma camada sobre a superfície, na qual o par redox catalisa as reações facilitando a transferências de elétrons entre a matriz contendo o analito e o sensor. Na literatura são apresentados como mediadores espécies tais como quinonas, tetratiofulvaleno, tetracianoquinodimetano, compostos organometálicos, bem como, fenóis naturais ou sintéticos. Tais mediadores, por serem polifuncionais, podem possuir uma versatilidade especialmente ao grupo hidroxila: (i) que facilita o processo de transferência de elétrons; (ii) pode ser ativado eletroquimicamente in situ, por meio da oxidação irreversível da hidroxila fenólica. A quinona resultante pode ser reduzida reversivelmente à correspondente hidroquinona, formando, portanto, um par redox na superfícies eletródica, por meio de um processo redox de 2e-/2H+. Esse par redox é um bom candidato a catalisador, tanto através dos dois elétrons envolvidos durante o processo redox, quanto pela liberação de prótons. Devido a estas vantagens, as técnicas eletroquímicas mostram-se viáveis para determinar moleculas de relevância biologica, tais como o ácido L-ascorbico (AA). [FERIN et al., 2013, CHOUKAIRI et al.,2015].
Material e métodos
Os seguintes reagentes foram utilizados sem tratamento prévio: capsaícina (CA), ácido ascórbico (AA), foram obtidos da Sigma-Aldrich, fosfato de sódio monobásico monoidratado (NaH2PO4.H2O), fosfato de sódio dibásico diidratado (Na2HPO4.2H2O), hidróxido de sódio (NaOH), ácido clorídrico (HCl) e ácido nítrico (HNO3) foram obtidos da Vetec. Nanotubos de carbono de paredes múltiplas (do inglês multi-walled carbon nanotubes, MWCNT), obtidos da Sigma, passaram por tratamento prévio com ácido nítrico (HNO3) (Figura 4). Um potenciostato modelo PGSTAT30 EcoChemie da AUTOLAB (Utrecht, The Netherlands), interfaceado a um microcomputador (software: GPES 4.9), foi empregado para as medidas eletroquímicas. Além disso, nos estudos amperométricos para obtenção da curva analítica foi empregado um eletrodo de disco rotatório (EDR), com uma velocidade de rotação otimizada (100 rpm). As medidas foram realizadas usando 5,0 mL de solução tampão fosfato 0,1 mol L-1, pH 7,0. A eliminação de oxigênio dissolvido foi feita pelo borbulhamento de um fluxo de nitrogênio (N2(g)) nas soluções, durante 10 minutos, antes das análises. Utilizou-se um sistema de três eletrodos em cela de vidro (5 mL): eletrodo de trabalho de carbono vítreo, eletrodo auxiliar fio de platina e Ag/AgCl, Cl- (0,1 mol L-1) como eletrodo de referência. Em um eppendorf, foram pesados 3,05 mg (10 mmol) de CAP e adicionados a 0,250 mL de Etanol (PA), antes das polimerizações, como solução estoque. Em um eppendorf, foi pesado 1 mg de MWCNT (obtido do tratamento com ácido nítrico) e adicionado 1,0 mL de DMF. Esta mistura ficou sob agitação no ultrassom por 2 horas para uma melhor dispersão. Esta solução foi preparada antes das análises e pôde ser utilizada durante um mês.
Resultado e discussão
Após obteção do voltamograma do branco, PBS pH 5,0, iniciou-se a varredura
na presença de capsaícina (Figura 1). Um pico anódico (IIIa) irreversível é
observado, em 0,51 V vs. Ag/AgCl/Cl-, seguido de aparecimento de onda
catódica (IIc), em 0,23 V. Nas varreduras subsequentes, pode-se observar a
formação de uma nova onda anódica (IIa) reversível, em 0,29 V. O sistema
IIc/IIa é caracteristico do sistema redox quinona/hidroquinona, como mostra
o mecanismo de oxidação da capsaícina na figura 3B. No intuito de verificar
a eficiência eletrocatalítica na presença de AA, assim como avaliar o
comportamento do acido L-ascorbico em tampão PBS pH 7,0, em diferentes
plataformas, (A) ECV, (B)ECV/MWCNT e ECV/MWCNT/cap, foram realizadas
análises na faixa de potencial entre -0,15 V a 0,1 V (Figura 2) observou que
o eletrodo proposto “C”, obteve a melhor resposta, foi possivel verificar a
formação de um pico anódico em 0,0V observa-se um aumento de corrente
anódica e diminuição da corrente catódica, verificando-se a influência da
presença da AA no eletrodo modificado ECV/MWCNT/poli-CAP. Este resultado
mostra um efeito sinérgico entre os nanotubos de carbono e a superfície
modificada com polímero de CAP para a oxidação catalítica do AA e na sua
determinação. Na figura 3 (A) o Cronoamperograma de duplo salto de potencial
direto e reverso para o mediador na ausência de AA mostraram-se simétricos
com um consumo de carga igual para redução e oxidação do sistema redox
eletrogerado na superfície do ECV/MWCNT/poli-CAP. Já na presença de
diferentes concentrações de AA, os valores da corrente anódica associada aos
amperogramas diretos são significativamente maiores do que aqueles
observados para o processo reverso (Figura 3A) e apos a integração podemos
verificar o consumo de carga (figura 3B).
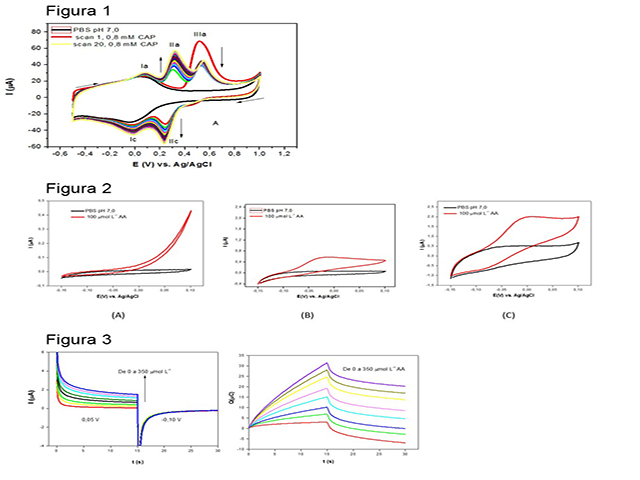
Voltamogramas Cíclicos na faixa de -0,15 a 0,1 V vs. Ag/AgCl e cronoamperogramas obtidos no ECV/MWCNT/poli-CAP em solução tampão fosfato.
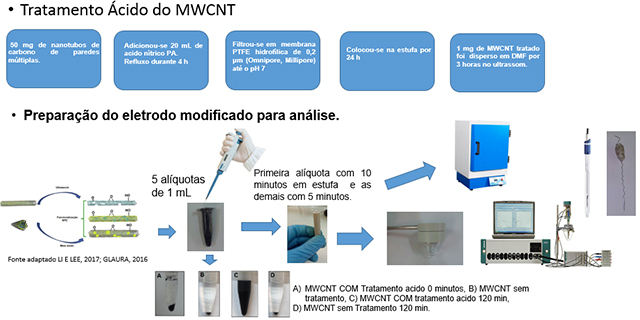
Tratamento ácido e preparação do eletrodo modificado para análise.
Conclusões
Os estudos eletrocatalíticos e cinéticos de AA em voltametria e cronoamperometria, empregando o sistema desenvolvido ECV/MWCNT/poli-CAP comprovaram a eficiência deste sistema em mediar a transferência de elétrons, envolvendo a molécula de AA. A plataforma nanoestruturada modificada pelo mediador poli-CAP foi capaz de promover o limite de detecção de 2,5µmol L-1 de AA, com boa sensibilidade e estabilidade. O sensor proposto é de fácil preparação quando comparado a vários materiais envolvidos na modificação de eletrodos, e os materiais envolvidos são de baixo custo e pouco tempo para análise.
Agradecimentos
CNPQ,FAPEAL, CAPES, UFAL.
Referências
LOWINSHON, D.; BERTOTTI, M. Sensores Eletroquímicos: Considerações sobre Mecanismos de Funcionamento e Aplicações no Monitoramento de Espécies Químicas em Ambientes Microscópicos. Quimica Nova. v. 29, n. 6, p. 1318 - 1325, 2006.
CHOUKAIRI, M., et al., Electrochemical detection of uric acid and ascorbic acid: application in sérum, jornal of electroanalytical Chemistry, 758,p 117-125, 2015.
FERIN, R., et al., Rapid, sensitive and simultaneous determination of ascorbic and uric acids in human plasma by ion exclusion HPLC-UV, clinical Biochemistry, 46,p.665-669,2013.
BARD, A; FAULKNER, L. Allen J. Bard and Larry R. Faulkner, Electrochemical Methods: Fundamentals and Applications, New York: Wiley, 2001. Russian Journal of Electrochemistry, v. 38, n. 12, p. 1505–1506, 2002.
NGAMCHUEA, K. et al. Planar diffusion to macro disc electrodes-what electrode size is required for the Cottrell and Randles-Sevcik equations to apply quantitatively? Journal of South American Earth Sciences.











