Técnica para determinação de agrotóxicos empregados na semeadura do arroz irrigado, visando à sustentabilidade da orizicultura
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Rebelo, A.M. (EPAGRI) ; Noldin, J.A. (EPAGRI) ; Scheuermann, K.K. (EPAGRI) ; Haro, M.M. (EPAGRI)
Resumo
O estudo associou a extração em fase sólida e cromatografia líquida empregando coluna C18 e fase móvel (A) metanol/água e (B) acetonitrila, acoplado ao detector DAD(222,4/278,4nm). Desta forma, se obteve limites de detecção e quantificação (LOQ) nas faixas de 0,2-0,8 ng/mL e 0,6-2,8 ng/mL, respectivamente. O método foi validado em termos de linearidade, precisão e exatidão. Seis amostras de áreas cultivadas com sementes tratadas com fipronil, tiofanato-metila e piraclostrobina, foram analisadas. O método foi capaz de detectar os agrotóxicos e cinco subprodutos tóxicos, em LOQ menores que os limites máximos estabelecidos em água. A técnica se mostrou eficiente para a tomada de decisão do momento que a água empregada na rizicultura pode ser descartada, tornando o manejo mais sustentável.
Palavras chaves
Química analítica ; Cromatografia; Validação de método
Introdução
Na rizicultura, para proteção de sementes, aplica-se fipronil, tiofanato-metila e piraclostrobina. Após a semeadura, nos primeiros estágios do cultivo, estes compostos devem ser os únicos encontrados na água, podendo atingir cursos de água após a drenagem. O fipronil é tóxico a organismos não-alvo (BIEVER et al., 2003; LI et al., 2015). Além disso, a piraclostrobina é tóxica a seres aquáticos (MORRISON et al., 2013) e tiofanato-metila a mamíferos, peixes e rotíferos (FEKI et al., 2017). Além disso, o fipronil (F) é degradado em F-sulfona, F-sulfeto, F- carboxamida e F-dessulfinil, que é tóxico para mamíferos (HAINZL e CASIDA, 1996; BOBÉ et al., 1998; RAMESH e BALASUBRAMANIAN, 1999; WU et al., 2017). Além disso, o tiofanato-metila se degrada no carbendazim, muito estável no ambiente e considerado substância perigosa prioritária na Europa (SAIEN e KHEZRIANJOO, 2008). A fim de garantir a segurança ambiental, no manejo que emprega sementes de arroz tratadas, é necessário saber a quantidade de resíduos do produto e de seus principais metabólitos ainda persiste (SANDAHL et al., 2000) antes de devolver as águas aos rios. Portanto, é necessário um método analítico sensível, simples e de relativo baixo custo, para a determinação de fipronil, tiofanato-metila, piraclostrobina e produtos de degradação. Esta metodologia será aplicada em programas de manejo de arroz de baixo impacto, desempenhando um papel importante como uma ferramenta para determinar se a água drenada deve ser liberada nos cursos naturais de água ou em tanques de decantação. Apresentamos metodologia que associa a extração em fase sólida e HPLC-DAD para a determinação de resíduos de tiofanato-metila, piraclostrobina, fipronil (F), F-carboxamida, F-desulfinil, F-sulfide, F-sulfona e carbendazin.
Material e métodos
O método foi validado quanto à linearidade e precisão para a concentração intermediária de cada faixa linear (n = 8); com obtenção dos limites de detecção e quantificação. Para avaliar a exatidão, foram realizados ensaios de recuperação com água pura e fortificada com todos os compostos. Em todos os testes de recuperação, três concentrações foram usadas para representar as faixas lineares. As curvas analíticas (contendo todos os compostos) foram plotadas em nove níveis de concentração de forma que a faixa linear do método pudessem quantificar os analitos abaixo de três nanogramas/mL (triplicata). No preparo de amostras, na fase de concentração, 450mL de água/amostra passaram por papel filtro e em cartucho Bond Elut C18 (500g, 6mL) (Agilent) (ativação: 10mL de metanol e 10mL de água) estes eram então congelados a -18°C e liofilizados (24h). Na fase de extração (sob vácuo) as amostras lavadas dos cartuchos com 9mL de acetonitrila evaporada a 45°C com ressuspensão da amostra com 0,5mL de fase móvel (1:1) para posterior injeção. A separação cromatográfica ocorreu em uma coluna Eclipse Plus C18, 150mm 4,6 mm x 5μm (Agilent), injetando-se 20μl de amostra. A fase móvel (450μL/min) foi composta por (A) metanol /água (60/35, v/v) e (B) acetonitrila, testando modo isocrático (DE OLIVEIRA SILVA et al., 2015) e com ajustes de gradientes. Para determinar o melhor comprimento de onda, empregou-se varredura por DAD para estabelecer a configuração que promovesse maior sensibilidade do método. O método proposto foi aplicado na determinação de agrotóxicos em seis amostras obtidas de áreas cultivo de arroz e de onde os produtos analisados foram empregados no tratamento de semente. Foram coletadas duas amostras de água antes e quatro após a semeadura.
Resultado e discussão
Na separação cromatográfica optou-se pela metodologia que utilizou gradiente de concentração onde solvente (A) foi empregado em: 0-5 min, 90%; 5-10 min, 90% a 60%; 10-15 min, 60%; 15-20 min, 60% a 90% favorecendo a separação de todos os compostos em tempos de
retenção distintos. Os comprimentos de onda selecionados após varredura foram 278,4nm para piraclostrobina e 222,4nm para os demais. Inicialmente todos os compostos eram misturados na fortificação das amostras, no entanto o tiofanato-metila degrada rapidamente
em carbendazim, sendo retirado dos testes de recuperação pela baixa recuperação e por aumentar a recuperação de seu subproduto de degradação. Na tabela 1, apresentam-se os parâmetros de validação. Para os compostos legislados quanto sua presença em água, é
possível quantificá-los em concentração pelo menos cinco vezes menor que a regulamentada (HAMILTON et al., 2003). Isto indica que o método proposto é adequado para monitorar os resíduos estudados. Amostras de água coletada antes da semeadura, não apresentaram
resíduos. Amostras coletadas após a semeadura apresentaram fipronil (13μg/mL) e F-dessulfinil (4,5μg/mL) além da detecção de carbendazim. Com base nos resultados, a descarga de água da arrozeira sem tratamento representa uma ameaça para o meio aquático e
terrestre, uma vez que o fipronil e o fipronil-dessulfinil são tóxicos para organismos não alvo. O método proposto foi considerado simples e completo para identificar e quantificar resíduos de ativos usados em tratamento de sementes na rizicultura, cumprindo os
critérios de identificação descritos em padrões internacionalmente reconhecidos.
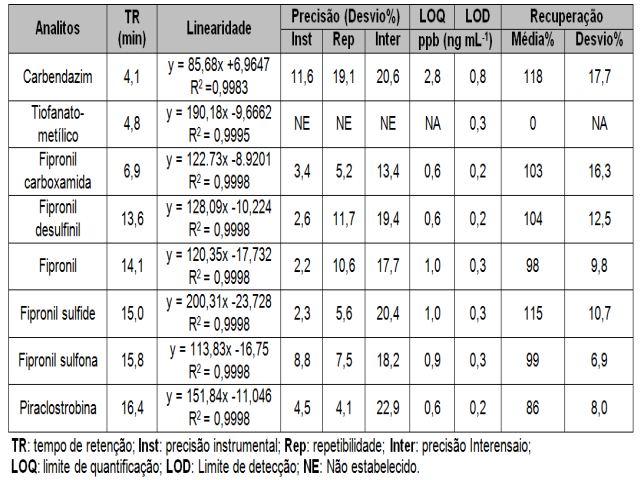
Parâmetros e dados obtidos na validação do método.
Conclusões
A associação da técnica de amostragem de extração em fase sólida e de separação cromatográfica de fácil execução por HPLC/DAD forneceu resultados confiáveis para o monitoramento de agrotóxicos e seus metabólitos em rotina laboratorial, devido às técnicas laboratoriais difundidas, aos baixos custos e ao volume relativo de solventes orgânicos e ao tempo necessário. O método proposto e validado destaca-se como uma ferramenta para monitorar resíduos de agrotóxicos empregados no tratamento de sementes de arroz, importante para que os manejos sugeridos sejam cada vez mais sustentável.
Agradecimentos
À Fundação de Amparo à Pesquisa e Inovação de Santa Catarina (FAPESC) e Finep. Ao Alexandre Ferreira Corrêa e Iremar Ferreira pelo trabalho de apoio nas rotinas laboratoriais.
Referências
BIEVER, R. C.; HOBERG, J. R.; JACOBSON, B.; DIONNE, E.; SULAIMAN, M.; MCCAHON, P. ICON rice seed treatment toxicity to crayfish (Procambarus clarkii) in experimental rice paddies. Environ Toxicol Chem, v. 22, n. 1, p. 167-74, Jan 2003.
BOBÉ, A.; COOPER, J.-F.; COSTE, C. M.; MULLER, M.-A. Behaviour of fipronil in soil under Sahelian Plain field conditions. Pesticide Science, v. 52, n. 3, p. 275-281, 1998.
DE OLIVEIRA SILVA, R.; ANDREA LIMA CARDOSO, C.; SCORZA JÚNIOR, R. Desenvolvimento e validação de um método analítico para quantificação de atrazina do fipronil e seus produtos de degradação em amostras de solo por cromatografia líquida de alta eficiência. Ciência e Natura, v. 37, n. 3, 2015.
FEKI, A.; BEN SAAD, H.; JABALLI, I.; MAGNE, C.; BOUDAWARA, O.; ZEGHAL, K. M.; HAKIM, A.; BEN ALI, Y.; BEN AMARA, I. Methyl thiophanate-induced toxicity in liver and kidney of adult rats: a biochemical, molecular and histopathological approach. Cell Mol Biol (Noisy-le-grand), v. 63, n. 2, p. 20-28, Feb 2017.
HAINZL, D.; CASIDA, J. E. Fipronil insecticide: novel photochemical desulfinylation with retention of neurotoxicity. Proc Natl Acad Sci U S A, v. 93, n. 23, p. 12764-7, Nov 1996.
HAMILTON, D. J.; AMBRUS, Á.; DIETERLE, R. M.; FELSOT, A. S.; HARRIS, C. A. Regulatory limits for pesticide residues in water. Pure Appl. Chem., v. 75, n. 8, p. 1123-1155, 2003.
LI, M.; LI, P.; WANG, L.; FENG, M.; HAN, L. Determination and dissipation of fipronil and its metabolites in peanut and soil. J Agric Food Chem, v. 63, n. 18, p. 4435-43, May 2015.
MORRISON, S. A.; MCMURRY, S. T.; SMITH, L. M.; BELDEN, J. B. Acute toxicity of pyraclostrobin and trifloxystrobin to Hyalella azteca. Environmental Toxicology and Chemistry, v. 32, n. 7, p. 1516-1525, 2013.
RAMESH, A.; BALASUBRAMANIAN, M. Kinetics and Hydrolysis of Fenamiphos, Fipronil, and Trifluralin in Aqueous Buffer Solutions. Journal of Agricultural and Food Chemistry, v. 47, n. 8, p. 3367-3371, 1999.
SAIEN, J.; KHEZRIANJOO, S. Degradation of the fungicide carbendazim in aqueous solutions with UV/TiO(2) process: optimization, kinetics and toxicity studies. J Hazard Mater, v. 157, n. 2-3, p. 269-76, Sep 2008.
SANDAHL, M.; MATHIASSON, L.; JÖNSSON, J. Å. Determination of thiophanate-methyl and its metabolites at trace level in spiked natural water using the supported liquid membrane extraction and the microporous membrane liquid–liquid extraction techniques combined on-line with high-performance liquid chromatography. Journal of Chromatography A, v. 893, n. 1, p. 123-131, 2000.
WU, X.; YU, Y.; XU, J.; DONG, F.; LIU, X.; DU, P.; WEI, D.; ZHENG, Y. Residue analysis and persistence evaluation of fipronil and its metabolites in cotton using high-performance liquid chromatography-tandem mass spectrometry. PLoS One, v. 12, n. 3, p. 1-12, 2017.











