Preparação, caracterização e aplicação de eletrodos do tipo MMO (Ti/Sn0,63Ta0,27Ir0,10Ox) na degradação eletroquímica de Ametrina
ISBN 978-85-85905-23-1
Área
Ambiental
Autores
Vasconcelos, V.M. (UNIT) ; Dória, A.R. (UNIT) ; Lima, S.F.S. (UNIT) ; Santos, B. F. S., B.F.S. (UNIT) ; Eguiluz, K. I. B., K.I.B. (UNIT) ; Salazar-banda, G.R. (UNIT)
Resumo
O objetivo do trabalho foi preparar, caracterizar e aplicar o eletrodo Ti/Sn0,63Ta0,27Ir0,10Ox, obtido pelo método de composição térmica, utilizando solução precursora com o líquido iônico, hidrogenossulfato de metilimidazólio. O substrato (Ti) foi totalmente recoberto pelo filme de óxidos, com morfologia de “barro rachado”, conferindo alta área superficial. O fator de morfologia de 0,8 reforça a grande quantidade de sítios internos do eletrodo, que levou 40 h para ser desativado em teste de vida acelerado. Além disso, removeu 81% de Ametrina em 30 min em meio de NaCl (20 mmolL-1) e Na2SO4 (0,05 mol L-1), aplicando-se 50 mA cm-2 com consumo energético de 2,14 wh/L e constante de velocidade aparente de 8,90 x 10-2 min-1. Portanto, o eletrodo pode ser aplicado à remoção de Ametrina.
Palavras chaves
Ametrina; Eletrodos de MOM; Oxidação Eletroquímica
Introdução
O Brasil lidera o consumo mundial de agrotóxicos desde 2008, sendo consumido no país anualmente em torno de 2,5 milhões de toneladas de agrotóxicos (SPADOTTO e GOMES, 2016). Esse consumo elevado de agrotóxicos tem levado a presença de resíduos de agrotóxicos em alimentos, na atmosfera, nas precipitações secas e úmidas, como chuvas, águas superficiais e subterrâneas (DELLAMATRICE e MONTEIRO, 2014). Os agrotóxicos compreendem uma variedade de moléculas com distintas propriedades que lhes conferem diferentes graus de persistência ambiental, mobilidade e potenciais tóxico, carcinogênico, mutagênico e teratogênico ou algum efeito endócrino a diversos organismos não-alvos, inclusive o ser humano (ARMAS et al., 2007). Alguns agrotóxicos são tão persistentes, que mesmo produtos banidos há cerca de 30 anos foram encontrados em algumas amostras de rios brasileiros, como os pesticidas clorados. Dessa forma, o consumo elevado de agrotóxicos pode refletir em sérios problemas ambientais e de saúde humana e animal, devido à contaminação do solo, lagos, lençóis freáticos e rios (DELLAMATRICE e MONTEIRO, 2014). A Ametrina é um agrotóxico do grupo das triazinas de classe III, ou seja, é classificado como pouco tóxico, não apresentando efeitos adversos para mamíferos e peixes, todavia é altamente tóxico para crustáceos e moluscos. A concentração necessária para matar 50% da população (LD50 do inglês Lethal Dose) de truta-arco-íris em 96 h de exposição à Ametrina é 8,8 mg L–1, para peixes prego azuis é 4,1 mg L–1, para peixes dourados é 14,1 mg L–1, para camarão é 2,3 mg L–1 e para algas verdes é 14 μg L–1 quando exposta por 72 h. A estrutura molecular da Ametrina constituída de ramificações e um grupo aromático, justifica a persistência desse composto no meio ambiente. Adicionalmente, a Ametrina pode mover-se tanto vertical quanto lateralmente no solo devido a sua alta solubilidade em água, podendo ainda ser lixiviado pelas águas da chuva, inundações e irrigação levando a presença do agrotóxico para águas e ambientes marinhos costeiros (FARRÉ et al., 2002). A preocupação com a presença de substâncias tóxicas na água tem levado ao desenvolvimento de técnicas que possam ajudar na remoção dessas substâncias do ambiente. Nesse âmbito, os processos oxidativos avançados eletroquímicos (POAEs) surgem como uma alternativa, devido à possibilidade de levar à completa mineralização de compostos orgânicos por meio de agentes altamente oxidantes eletrogerados. Todavia, o material anôdico a ser empregado nos POAEs ainda apresenta um desafio para aplicação dessa tecnologia (BRILLAS e MARTÍNEZ-HUITLE, 2015). Os eletrodos de Misturas de Óxidos Metálicos (MOMs) apresentam a vantagem da facilidade de preparação, podendo levar a um menor valor agregado, o que favorece a aplicação industrial desses eletrodos. Os MOM são constituídos de um substrato, normalmente Ti, recoberto por uma mistura de óxidos metálicos, que conferem as propriedades dos eletrodos definindo a atividade catalítica (WU;HUANG e LIM, 2014). Esses eletrodos são classificados como ativos, pois durante a oxidação da água geram radicais hidroxila que ficam quimissorvidos a superfície do eletrodo, pois, há uma forte interação do eletrodo com os radicais hidroxila, formando óxidos superiores. Esses óxidos podem atuar na oxidação dos compostos orgânicos ou podem ser convertidos em oxigênio. Além disso, em meio de íons cloreto, outras espécies fortemente oxidantes podem ser geradas, dentre elas o ácido hipocloroso (HClO) e o íon hipoclorito (ClO–), como mostra das Equações (1–9) (COMNINELLIS, 1994; RAJKUMAR e KIM, 2006). MOx + H2O → MOx(•OH)ads + H+ + e– (1) MOx(•OH)ads → MOx+1 + H+ + e– (2) MOx+1 + R → (M) + RO (3) [MOx(•OH)]y + R → 2y CO2 + 2y H+ + 2y e– + y MOX (4) MOx+1 → M + ½ O2 (5) 2Cl– ⇄ Cl2(el) + 2e– (6) Cl2(el) ⇄ Cl2(sol) (7) Cl2(sol) + H2O → HClO + Cl– + H+ (8) HClO ⇄ H+ + ClO– (9) Devido à geração dessas diferentes espécies oxidantes é que os POAEs são altamente eficientes na remoção de compostos orgânicos poluentes que são oxidados química e eletroquimicamente na superfície do eletrodo e pelas espécies eletrogerados que estão no seio da solução ou adsorvidas ao MOM. Logo, as espécies oxidantes eletrogeradas interferem no mecanismo de oxidação das espécies poluentes, sendo que, a geração dessas espécies depende intrinsecamente da natureza e o tipo do material eletródico empregado (SIRES et al., 2014). Dessa forma, o objetivo do trabalho é preparar, caracterizar eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox e aplicar no processo oxidativo eletroquímico da Ametrina em meio de sulfato de sódio na presença e na ausência de NaCl.
Material e métodos
O eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox foi preparado pelo método de decomposição térmica usando solução precursora contendo os sais metálicos em líquido iônico, hidrogenossulfato de metilimidazólio na concentração de 1 mol L–1. A completa dissolução dos sais no líquido iônico foi alcançada utilizando-se ultrassom de ponteira e aquecimento a 90ºC. O substrato de Ti foi pré-tratado com álcool isopropílico, ácidos clorídrico (20%) e oxálico (10%) a fim de remover gorduras, retirar óxidos e hidróxidos de titânio. O tratamento ácido leva a corrosão superficial do substrato de Ti, levando a remoção de óxidos, o que confere rugosidade superficial ao substrato, resultando no aumento de ligações interfaciais entre o revestimento e o substrato por causa da maior área de contato superficial (SON;PARK e LEE, 2017). Após o tratamento do substrato, aplicou-se a solução precursora através de pinceladas. Em seguida, os eletrodos foram levados para calcinação a 550ºC com taxa de aquecimento de 10 ºC min–1 até que atingissem a massa de 1,2 mg cm–2. Por fim, os eletrodos foram levados para calcinação final durante 60 minutos. A análise morfológica dos ânodos foi realizada por microscopia eletrônica de varredura, usando um microscópio JEOL JCM 5700, com ampliações de 2000x. Na caracterização eletroquímica utilizou-se célula eletroquímica de um compartimento com contendo 3 eletrodos: eletrodo de trabalho: eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox, contra-eletrodo: placa de Pt, eletrodo de referência: Ag/AgCl não comercial em solução de 3 mol L–1 de KCl. As análises realizadas foram voltametria cíclica em Na2SO4 0,05 mol L–1 no intervalo potencial de –0,5 a 1,2 V com velocidade de varredura de 50 mV s– 1. O fator de morfologia foi determinado como proposto (SILVA;FARIA e BOODTS, 2001) a partir dos voltamogramas cíclicos obtidos em diferentes velocidades de varreduras (10, 20, 30, 40, 50, 100, 150, 200, 250 e 300 mV s–1) no intervalo de corrente capacitiva (0,8–0,9 V). A análise de impedância foi realizada no potencial de início da reação de desprendimento de oxigênio com frequência variando de 1000 a 0,1 Hz e amplitude de sinal 5 mV. O tempo de vida acelerado foi estudado em solução aquosa de H2SO4 1 mol L–1 aplicando-se 100 mA cm–2. O eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox foi aplicado na degradação eletroquímica de solução contendo 25 mg L–1 de Ametrina em meio de Na2SO4 0,05 mol L–1 na presença ou ausência de NaCl 20 mmol L–1 a temperatura ambiente, com agitação de 720 rpm, aplicando-se 50 mA cm–2. O volume total da solução foi 230 mL. A concentração de Ametrina foi monitorada utilizando cromatografia líquida de alta eficiência (do inglês HPLC) com coluna C18 de fase reversa Phenomenex (150 mm × 4,6, tamanho de partícula de 5μm) a 30ºC. A fase móvel foi acetonitrila e água ultrapura na proporção 60 e 40%, respectivamente, com fluxo de 1 mL min–1. Injetou-se 20µL da amostra e o comprimento de onda de detecção foi 240 nm.
Resultado e discussão
O substrato de Ti foi totalmente recoberto pelo filme de
Sn0,63Ta0,27Ir0,10Ox, formando o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox como
pode ser observado a Figura 1a, na qual, o substrato de Ti não está exposto.
Além disso, percebe-se a constituição de placas no filme de óxidos na
superfície do eletrodo com presença de trincas e poros, conferindo alta área
superficial aos eletrodos. Essa morfologia de trincas e poros semelhante à
morfologia típica de “barro rachado” é característica de eletrodos de MOMs,
devido aos diferentes coeficientes de expansão do filme e do substrato,
podendo ser originada tanto durante o resfriamento do eletrodo, quanto na
etapa de evaporação do solvente na fase de aquecimento por causa do choque
térmico no processo de calcinação (BERENGUER et al., 2014).
A morfologia de “barro rachado” apesar de conferir ao eletrodo elevada área
superficial, o que aumenta a quantidade de sítios ativos no eletrodo,
favorecendo as reações químicas; também permite que o eletrólito permeei a
superfície do eletrodo e alcance o substrato, podendo, ocorrer passivação
dos filmes, pela reação entre eletrólito e substrato, formando um filme
isolante de dióxido de titânio, em meio de eletrólito ácido, ocasionado a
diminuição da atividade catalítica do eletrodo, aumento do sobrepotencial
durante a eletrólise, ou mesmo a desativação do eletrodo (CARDARELLI et al.,
1998).
A elevada área interna do eletrodo pode ser comprovada pelo fator de
morfologia calculado pela divisão entre os valores de capacitância
diferencial interna e capacitância diferencial total, portanto, quanto mais
próximo de 1,0 for o valor do fator de morfologia mais sítios internos há no
eletrodo. O valor calculado para o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox foi
igual a 0,8. Dessa forma, o eletrodo apresenta grande número de sítios
internos, característica de eletrodos rugosos como o caso dos eletrodos de
MOMs.
O perfil voltamétrico do eletrodo (Figura 1c) mostra que o desprendimento de
oxigênio a partir da oxidação da água inicia-se a 1,1 V vs. Ag/AgCl. Dessa
forma, em reações de oxidação eletroquímica de compostos orgânicos
realizadas a partir desse potencial, parte da corrente aplicada será
destinada a produção de oxigênio, que é uma reação paralela a reação de
oxidação da água formando radicais hidroxila (·OH), que atua como agente
oxidante forte.
A resistência a transferência de corrente na região de início do
desprendimento de oxigênio foi calculado utilizando a técnica de
espectroscopia de impedância eletroquímica, os dados experimentais
selecionados foram modelados (Figura 1d - símbolo: curva experimental e
linha: curva teórica) para obter o melhor ajuste a um circuito equivalente
utilizando o software Zview2, sendo que quanto menor o valor do χ2 melhor é
o ajuste.
O circuito equivalente que melhor ajustou-se aos dados constitui-se de um
resistor (RΩ), que representa a resistência ôhmica do sistema, em série com
outro resistor (Rtc), referente a resistência de transferência de carga para
a reação de desprendimento de oxigênio, em paralelo a um elemento de fase
constante (CPE) devido à dispersão da capacitância da dupla camada elétrica
encontrada em eletrodos porosos ou rugosos que não se comportam como um
capacitor ideal. O desvio do comportamento ideal é estimado pelo valor de n,
que está contido em 0 e 1. Os valores de RΩ, Rtc, CPE e n simulados para a
interface eletrodo/solução foram 18 Ω, 225 Ω, 5,1 × 10–3 e 0,70,
respectivamente, com valor de χ2 melhor igual a 1,1 × 10–4. Portanto, a
resistência a passagem de corrente é 18 Ω, essa resistência é oriunda da
resistência ôhmica do eletrólito, do eletrodo e dos contatos elétricos. A
resistência a transferência eletrônica a reação de oxidação da água é 225 Ω.
O valor de resistência a passagem de corrente está associado ao consumo
energético, como o desprendimento de oxigênio é uma reação paralela a de
oxidação, é de suma importância o conhecimento dessa região para a aplicação
de eletrodos no estudo de degradação.
Além disso, para que os eletrodos possam ser aplicados industrialmente é
necessário ter um tempo de vida que permita o uso do eletrodo por longo
período. O teste de vida acelerado do eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox
foi realizado em meio de H2SO4 1 mol L–1 aplicando-se 100 mA cm–2. Nessa
condição foram necessárias 40 h de eletrólise para observar uma grande
variação no sobrepotencial. Dessa forma, o eletrodo pode ser aplicado na
oxidação eletroquímica de composto orgânico, o modelo de poluente
selecionado foi a Ametrina. A Figura 1b mostra a imagem MEV do eletrodo após
as 40h de eletrólise, percebe-se uma grande alteração na morfologia do
filme, que está menos rugosa e com uma quantidade de placas bem menor que na
Figura 1a, todavia, o substrato (Ti), não foi exposto, evidenciando a
qualidade de adesão do filme ao substrato conferida pelo método de
preparação do eletrodo.
A eficiência da atividade catalítica do eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox
em oxidar a Ametrina foi avaliada em meio de solução aquosa de Na2SO4 0,05
mol L–1 na presença e na ausência de NaCl (20 mmol L–1) aplicando-se 50 mA
cm–2. A concentração de Ametrina foi monitorada utilizando curva de
calibração obtida por cromatógrafo. O perfil de decaimento de concentração
da Ametrina normalizado (Figura 2) mostra que não houve remoção da Ametrina
na ausência de NaCl, todavia na presença de NaCl 81% da Ametrina foi
removida em 30 min de eletrólise. Em meio de NaCl ocorre tanto a oxidação
direta quanto indireta da Ametrina. Na ausência de NaCl ocorre apenas a
degradação na superfície do eletrodo (oxidação direta). Logo, a degradação
na ausência de NaCl depende dos processos de difusão e transporte de massa
da Ametrina a superfície do eletrodo, bem como da quantidade de sítios
ativos disponíveis na superfície do eletrodo, tornando o processo de reação
bem lento, por ser, um processo unicamente heterogêneo. Na presença de NaCl,
tem-se a geração de espécies oxidante, por causa dos íons cloretos em
solução, essas espécies ficam disponíveis no seio da solução, levando ao
sinergismo dos processos de oxidação na superfície do eletrodo e no seio da
solução. Portanto, a degradação ocorre mais rapidamente na presença de NaCl,
sendo uma reação de pseudo primeira ordem com constante de velocidade
aparente igual 8,90 × 10–2 min–1.
O consumo energético (CE) necessário para o tratamento da solução contendo
Ametrina com volume de 230 mL e utilizando o eletrodo de
Ti/Sn0,63Ta0,27Ir0,10Ox com área de 2,34 cm2 foi calculado utilizando a
equação: CE = EI∆t/ V, na qual, E (V) é a média do potencial de célula –
potencial entre eletrodo de trabalho e contra-eletrodo, I (A) é a corrente
média aplicada, ∆t (h) é o tempo de eletrólise e V (L) é o volume da solução
eletródica. O CE na presença e ausência de NaCl foi de 1,99 e 2,14 Wh/L,
respectivamente. Apesar do CE ser um pouco maior na presença de NaCl,
porque, houve aumento do E de 7,8 V para 8,4 V na ausência e na presença de
NaCl, respectivamente. Na ausência de NaCl não há remoção da Ametrina.
Portanto, em meio de NaCl o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox pode ser
utilizado para remover Ametrina de solução aquosa.
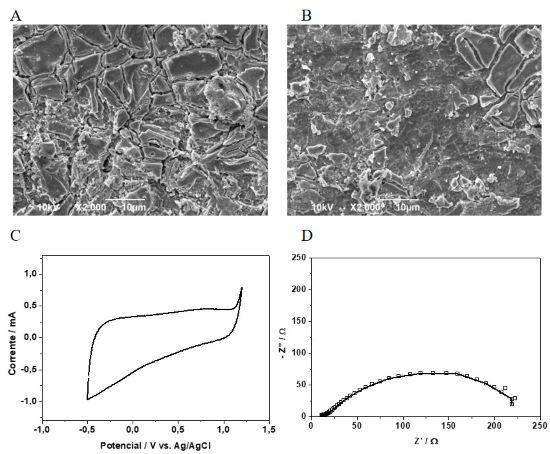
Imagens MEV dos eletrodos de Ti/Sn0,63Ta0,27Ir0,10Ox a) ativado e b) desativado, c) perfil voltamétrico e d) diagrama de Nyquist.
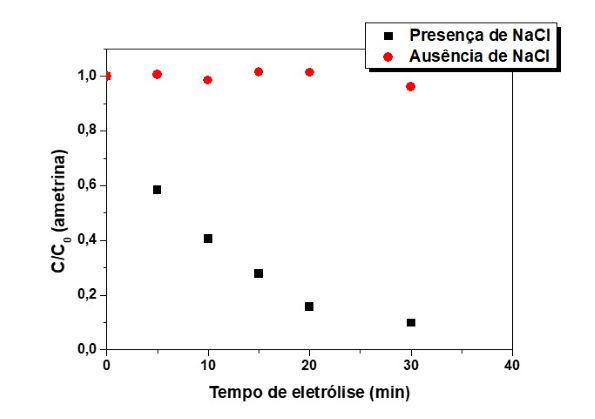
Decaimento de concentração da Ametrina na presença ou ausência de 20 mmol L–1 de NaCl em meio de Na2SO4 0,05 mol L–1 aplicando-se 50 mA cm–2.
Conclusões
O eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox foi produzido pelo método de decomposição térmica utilizando solução precursora contendo o líquido iônico, hidrogenossulfato de metilimidazólio. O substrato de Ti foi totalmente recoberto pelo filme de óxidos metálicos, que apresentaram morfologia características dos eletrodos de MMO. Morfologia essa de “barro rachado”, que além de conferir elevada área superficial ao eletrodo também permite sua desativação, pela interação entre substrato e eletrólito. O eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox foi desativado após 40 h de eletrólise em meio de H2SO4 1,0 mol L–1 aplicando-se 100 mA cm–2. Todavia, mesmo após a desativação do eletrodo, o substrato continuou recoberto pelo filme de óxidos, o que comprova a qualidade de adesão do filme de óxidos ao Ti que o método de preparação proposto confere. Uma reação paralela à reação de oxidação de Ametrina é a reação de desprendimento de oxigênio, dessa forma é importante saber em qual potencial, a reação ocorre, bem como, a resistência a essa transferência eletrônica. Para o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox, o desprendimento de oxigênio inicia a 1,1 V vs. Ag/AgCl com resistência de 255 Ω. A eficiência do processo de degradação da Ametrina utilizando o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox é dependente do meio eletrólito. Na ausência de NaCl não houve remoção da Ametrina, contudo, na presença de NaCl 81% da Ametrina foi removida em 30 min de eletrólise com consumo energético de 2,14 Wh/L, mostrando um comportamento do decaimento de concentração normalizado de pseudo primeira ordem com constante de velocidade aparente de 8,90 × 10–2 min–1. Portanto, o eletrodo de Ti/Sn0,63Ta0,27Ir0,10Ox pode ser aplicado na remoção química-eletroquímica de Ametrina em solução aquosa.
Agradecimentos
Às agências: Capes, CNPq e FAPITEC/SE, pelo apoio ao Programa de apoio a pós- doutorado no estado de Sergipe (PPDOC-SE) - Edital N 01/2016. Ao Prof. Dr. Ronaldo Santos
Referências
ARMAS, E. D.; MONTEIRO, R. T. R.; ANTUNES, M. L.; SANTOS, M. P. F.; CAMARGO, P. B.; ABAKERLI, R. B. Diagnóstico espaço-temporal da ocorrência de herbicidas nas águas superficiais e sedimentos do rio corumbataí e principais afluentes. Quimica Nova, v 30, nº 5, 1119–1127, 2007.
BERENGUER, R.; SIEBEN, J. M.; QUIJADA, C.; MORALLON, E. Pt- and Ru-doped SnO(2)-Sb anodes with high stability in alkaline medium. ACS Applied Mater Interfaces, v 6, nº 24, 22778–22789, 2014.
BRILLAS, E.; MARTÍNEZ-HUITLE, C. A. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods. An updated review. Applied Catalysis B: Environmental, v 166–167, 603–643, 2015.
CARDARELLI, F.; TAXIL, P.; SAVALL, A.; COMNINELLIS, C.; MONOLI, G.; LECLERC, O. Preparation of oxygen evolving electrodes with long service life under extreme conditions. Journal of Applied Electrochemistry, v 28, 245–250, 1998.
COMNINELLIS, C. Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment. Electrochimica Acta, v 39, nº 11/12, 1857–1862, 1994.
DELLAMATRICE, P. M.; MONTEIRO, R. T. R. Principais aspectos da poluição de rios brasileiros por pesticidas. Revista Brasileira Engenharia Agrícola Ambiental, v 18, nº 12, 1296–1301, 2014.
FARRÉ, M.; FERNANDEZ, J.; PAEZ, M.; GRANADA, L.; BARBA, L.; GUTIERREZ, H. M.; PULGARIN, C.; BARCELÓ, D. Analysis and toxicity of methomyl and ametryn after biodegradation. Analytical and Bioanalytical Chemistry, v 373, 704–709, 2002.
RAJKUMAR, D.; KIM, J. G. Oxidation of various reactive dyes with in situ electro-generated active chlorine for textile dyeing industry wastewater treatment. Journal Hazard Material, v 136, nº 2, 203–212, 2006.
SILVA, L. M.; FARIA, L. A.; BOODTS, J. F. C. Determination of the morphology factor of oxide layers. Electrochimica Acta, v 47, 395–403, 2001.
SIRES, I.; BRILLAS, E.; OTURAN, M. A.; RODRIGO, M. A.; PANIZZA, M. Electrochemical advanced oxidation processes: today and tomorrow. A review. Environmental Science and Pollution Research, v 21, nº 14, 8336–8367, 2014.
SON, S. H.; PARK, S. C.; LEE, M. S. Enhancement of Life Time of the Dimensionally Stable Anode for Copper Electroplating Applications. Archives of Metallurgy and Materials, v 62, nº 2, 2017.
SPADOTTO, C. A.; GOMES, M. A. F. Agrotóxicos no Brasil. http://www.agencia.cnptia.embrapa.br/gestor/agricultura_e_meio_ambiente/arvore/CONTAG01_40_210200792814.html, 2016. Acesso em: 20/06/2016.
WU, W.; HUANG, Z.-H.; LIM, T.-T. Recent development of mixed metal oxide anodes for electrochemical oxidation of organic pollutants in water. Applied Catalysis A: General, v 480, 58–78, 2014.











